Als Rod MacKinnon am Neujahrstag 1998 erwachte, fürchtete er, dass alles nur ein Traum gewesen sein könnte. Bis spät in die Nacht hatte er an der Synchrotron-Strahlungsquelle der Cornell-Universität in Ithaka (NY) Daten aufgenommen, um die Struktur eines Kaliumkanals aus der Zellmembran zu ermitteln – einer Art Schleuse für geladene Teilchen. Seine Kollegen waren nach Hause gegangen, und er hatte alleine weitergearbeitet. Mitternacht war vorüber, und mit jeder Neuberechnung der Daten gewann das Bild des Kanals auf seinem Computerschirm an Schärfe. Schließlich begannen sich die Umrisse einzelner Kaliumionen abzuzeichnen, aufgereiht wie die Spielkugeln eines Flipper-Automaten – genauso, wie es Alan Hodgkin fast fünfzig Jahre zuvor prophezeit hatte: „Ions must be constrained to move in a single file, and there should on average, be several ions in the channel at any moment“. MacKinnon war total aus dem Häuschen …
Festgesetzt – Ein Molekül in Handschellen
Es war kein Traum. Tatsächlich hatte Rod MacKinnon eine wissenschaftliche Glanztat vollbracht, die ihm fünf Jahre später den Nobelpreis für Chemie einbringen sollte. Dabei hatten viele Kollegen die Erfolgsaussichten von MacKinnons Vorhaben, die Struktur von Ionenkanälen zu enthüllen, stark bezweifelt. Es galt als extrem schwierig, tierische oder pflanzliche Membranproteine für Röntgenstruktur-Untersuchungen zu kristallisieren. Gewohnt, sich einzeln in eine Lipidschicht einzubetten, zeigen Membranproteine nämlich wenig Neigung, sich mit ihresgleichen zu einem Kristall zusammenzulagern. Warum kam der Amerikaner zum Erfolg, wo andere gescheitert waren? Zunächst wählte Mac Kinnon für seine Arbeiten einen Ionenkanal, der aus einem sehr wärmeliebenden (hyperthermophilen) Bakterium stammt. Die Proteine solcher Organismen erlangen die für ihre Funktion notwendige Beweglichkeit erst bei hohen Temperaturen, im Bereich um 20°C sind sie sehr viel starrer als entwicklungsgeschichtlich verwandte Moleküle anderer Organismen. Sie lassen sich daher etwas einfacher in eine gemeinsame Form bringen. Diesen ersten Kristallen fehlte aber immer noch die notwendige exakte innere Ordnung. Die Forscher mussten daher zu einem weiteren Trick greifen: Um das Proteinmolekül endgültig festzusetzen, entwickelten sie einen monoklonalen Antikörper, der sich mit einer speziellen Bindungsstelle genau an jene Region des Kanalproteins heftet, in der offenbar die größte Beweglichkeit herrscht. Auf die unspezifischen Teile des Antikörpers konnten die Forscher im Weiteren verzichten – für ihre Kristallisationsexperimente nutzten sie lediglich das spezifische Teilstück, das so genannte Fab-Fragment. Die damit hergestellten Kristalle lieferten dann die Röntgenbeugungsdaten, aus denen sich jene hoch aufgelöste Struktur des Ionenkanals ableiten ließ, die im Mai 1998 die Titelseite der renommierten Fachzeitschrift Nature zierte.
Die Suche nach Kanälen
Das war nahezu ein halbes Jahrhundert nachdem Alan Hodgkin, Andrew Huxley und Bernhard Katz in Großbritannien Aktionspotenziale am Riesenaxon des Tintenfisches untersucht hatten. Ihre Messungen bestätigten das so genannte Membrankonzept: Danach basieren alle bekannten elektrischen Signale – Aktionspotenziale, synaptische Signale und Rezeptorpotenziale – auf Änderungen in der Membranpermeabilität, also der Durchlässigkeit der Membran für Ionen. Um die bei einem Aktionspotenzial auftretenden Änderungen in der Leitfähigkeit der Membran formal beschreiben zu können, entwickelten Hodgkin und Huxley die Vorstellung von spannungsgeregelten Ionenkanälen. Dafür erhielten die beiden Physiologen aus Cambridge 1963 den Nobelpreis für Medizin. Die Bezeichnung Natriumkanal und Kaliumkanal wurde seither vielfach benutzt, obwohl es keinen direkten Beweis für die Existenz solcher Kanäle auf der Basis biologischer Präparationen gab.
Im Falle künstlicher Membranen war das anders. Diese „black lipid membranes“ dienten seit Ende der 1960er Jahre als experimentelles Modellsystem und ähnelten in vielerlei Hinsicht der Lipidmembran lebender Zellen. Die Membranen stellten sehr gute Isolatoren dar; aber versetzt mit Antibiotika oder Proteinen wurden sie elektrisch leitfähig. Weil der hindurchfließende Strom sich stufenartig änderte, vermuteten die Wissenschaftler, dass einzelne Proteinmoleküle Kanäle durch die künstliche Membran bilden, wobei die Stufen dem Öffnen und Schließen dieser Kanäle entsprechen. Ähnliche Untersuchungen an biologischen Membranen ließen sich zu diesem Zeitpunkt noch nicht durchführen. Die Methoden zur Messung elektrischer Ströme an lebenden Zellen lieferten ein Hintergrundrauschen, das zwar nur zehn Milliardstel Ampere (100 pA) betrug, damit aber immer noch hundert Mal größer war, als die an den künstlichen Membranen beobachteten Einzelkanalströme. Also mussten die Forscher über neue Messmethoden nachdenken.
Am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften in Göttingen taten das in den 1970er Jahren Erwin Neher und Bert Sakmann. Die Messgeräte würden, so die Überlegung der beiden Wissenschaftler, nur dann mit der gewünschten Empfindlichkeit ansprechen, wenn es gelänge, aus der Zellmembran ein sehr kleines Areal zu isolieren (einen Membranfleck oder „patch“). Dazu benutzten sie eine mit einer elektrisch leitenden Flüssigkeit gefüllte Glaspipette, die sie auf eine enzymatisch gereinigte Muskelfaser aufsetzten – in der Hoffnung auf diese Weise einige wenige Ionenkanäle von der übrigen Membran isolieren zu können und damit ein klares Messsignal zu erhalten. Es erwies sich allerdings als äußerst schwierig, eine dichte Verbindung zwischen der Glaspipette und der Membran herzustellen. Die beiden Max-Planck- Forscher kämpften mit Lecks, durch welche die Flüssigkeiten außerhalb und innerhalb der Pipette in Kontakt gerieten. Also optimierten sie die Pipettenspitze und reinigten die Zelloberfläche noch sorgsamer.
 [2]
[2]Abb. A1: Durch einen halboffenen Käfig wird die Messapparatur im Labor vor elektrisch störenden Einflüssen abgeschirmt.
© W. Filser, MPG / CC BY-NC-SA 4.0
Lauschangriff auf die Zellmembran
1976 wurden ihre Mühen endlich belohnt: Erstmals konnten die Wissenschaftler an der neuromuskulären Synapse, der Kontaktstelle zwischen Nervenfaser und Muskelzelle, Ströme durch einzelne Kanäle beobachten. Diese ersten Messungen bestätigten viele ältere Annahmen über Einzelkanalströme – insbesondere die Vermutung, dass die elektrischen Signale in Pulsen stets gleicher Amplitude (Stromgröße), aber von unterschiedlicher Dauer auftreten.
Einige Jahre später entdeckten Neher und Sakmann durch Zufall, dass sich der elektrische Widerstand der Signalquelle um mehrere Zehnerpotenzen auf mehr als eine Milliarde Ohm (GΩ) erhöhen ließ, wenn man in der Glaspipette einen kleinen Unterdruck erzeugte und so den Membranfleck leicht ansaugte. Damit wurde das Hintergrundrauschen noch geringer, und die Forscher konnten nun auch Ionenkanäle anderer Synapsen-Typen untersuchen. Für diese mittlerweile zum Standard in den elektrophysiologischen Forschungslabors zählende Methode, die „Patch-Clamp-Technik“, bekamen die beiden Deutschen 1991 den Nobelpreis für Medizin (Abb. A1 und A2).
 [3]
[3]Abb. A2: Detailbild von der Mess- und Haltepipette unter dem Mikroskopobjektiv bei einer Patch-Clamp-Messung.
© W. Filser, MPG / CC BY-NC-SA 4.0
Ein passgenauer Tunnel für Ionen
Auch Nobelpreisträger Rod MacKinnon hatte zunächst mit der Patch-Clamp-Technik versucht, die Eigenschaften von Ionenkanälen zu erforschen (Abb. B). Dazu veränderte er Schlüsselstellen des Kanals mit gentechnischen Methoden – er tauschte also bestimmte Aminosäuren aus – und prüfte anschließend, wie sich das auf die Kanaleigenschaften (z. B. die Leitfähigkeit) auswirkte. Auf diese Weise konnte er grundsätzliche Aussagen zur Struktur des von ihm untersuchten bakteriellen Kaliumkanals treffen: Demnach besteht diese Ionenschleuse aus vier Untereinheiten, die die Zellmembran durchspannen und sich dabei um eine zentrale Pore gruppieren. MacKinnon konnte genau zeigen, welche der Aminosäuren die Selektivität des Kanals festlegen – ihn also nur für Kaliumionen, nicht aber für andere Ladungsträger durchlässig machen. Zu ähnlichen Einsichten war man zuvor schon beim Studium von Natriumionen leitenden Kanälen gelangt.
Doch alle diese Ergebnisse warfen neue Fragen auf, die sich mit molekularbiologischen und elektrophysiologischen Methoden alleine nicht beantworten ließen. Wie waren die Untereinheiten räumlich angeordnet? Und wie war es möglich, dass diese Kanäle hochselektiv waren und gleichzeitig enorme Durchflussraten erlaubten?
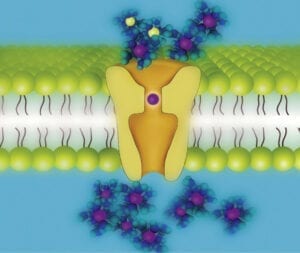
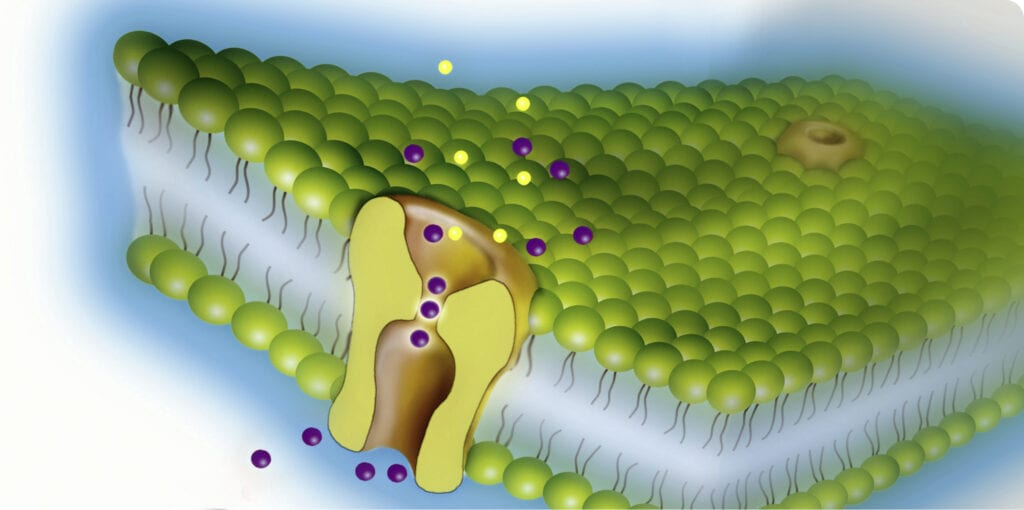
Abb. B: Die Kanalpore stellt den Selektivitätsfilter dar – hier entscheidet sich, welches Ion durchgelassen wird und welches nicht. Kaliumionen (lila) passieren die Kanalpore ohne ihre Hydrathülle.
© MPG; HN / CC BY-NC-SA 4.0
Um diese Fragen zu klären, begann MacKinnon sich mit Kristallographie zu beschäftigen – Voraussetzung für Röntgenstruktur – Untersuchungen. Seine daraus resultierenden Arbeiten enthüllten schließlich die molekulare Basis dieses Phänomens, über das sich die Forscher jahrzehntelang den Kopf zerbrochen hatten: Durch die dreidimensionale Struktur des Ionenkanals wirkt dieser als hocheffizienter Filter. Die engste Stelle im Kanal, der sogenannte Selektivitätsfilter sorgt dafür, dass nur Kaliumionen mit ihrer charakteristischen Größe und Ladung passieren können. Doch wie gelingt es, Kaliumionen so rasant durchzuschleusen (pro Millisekunde strömen etwa 10.000 Kaliumionen durch die Membran)?
Forscher am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften und der Universität Dundee (UK) haben herausgefunden, dass der Kanal in der Lage ist, die Ionen trotz ihrer starken elektrostatischen Abstoßungskräfte direkt hintereinander zu leiten. „Tatsächlich funktioniert dieser Mechanismus völlig anders als bisher gedacht“, erklärt der Chemiker Bert de Groot. Mithilfe aufwändiger Computersimulationen konnte sein Team die vorhandenen kristallografischen Daten viel genauer auswerten als bisher und den Kaliumkanälen direkt „bei ihrer Arbeit“ zuschauen (Abb. C). An der Engstelle des Kanals, dem Selektivitätsfilter, sitzen die Kaliumionen aufgereiht wie auf einer Perlenschnur sehr eng beieinander. Und anders als bisher vermutet, gibt es keine Wassermoleküle, die die geladenen Teilchen voneinander abschirmen. Weniger als ein millionstel Millimeter sind die Ionen voneinander entfernt. Diese räumliche Nähe führt dazu, dass sich die positiven Ladungen gegenseitig abstoßen. Durch anziehende Wechselwirkungen mit den kanalbildenden Polypeptidketten wird jedoch ein Gleichgewicht der Kräfte eingestellt. Diese feine Balance wird empfindlich gestört, wenn ein neues Kaliumion in den Kanal eintritt. Denn jetzt überwiegt die Abstoßung der positiven Ladungen und das Kaliumion, das am nächsten zum Kanalausgang sitzt, wird hinausgedrängt. Dadurch wird der Durchfluss durch den Kanal beschleunigt.
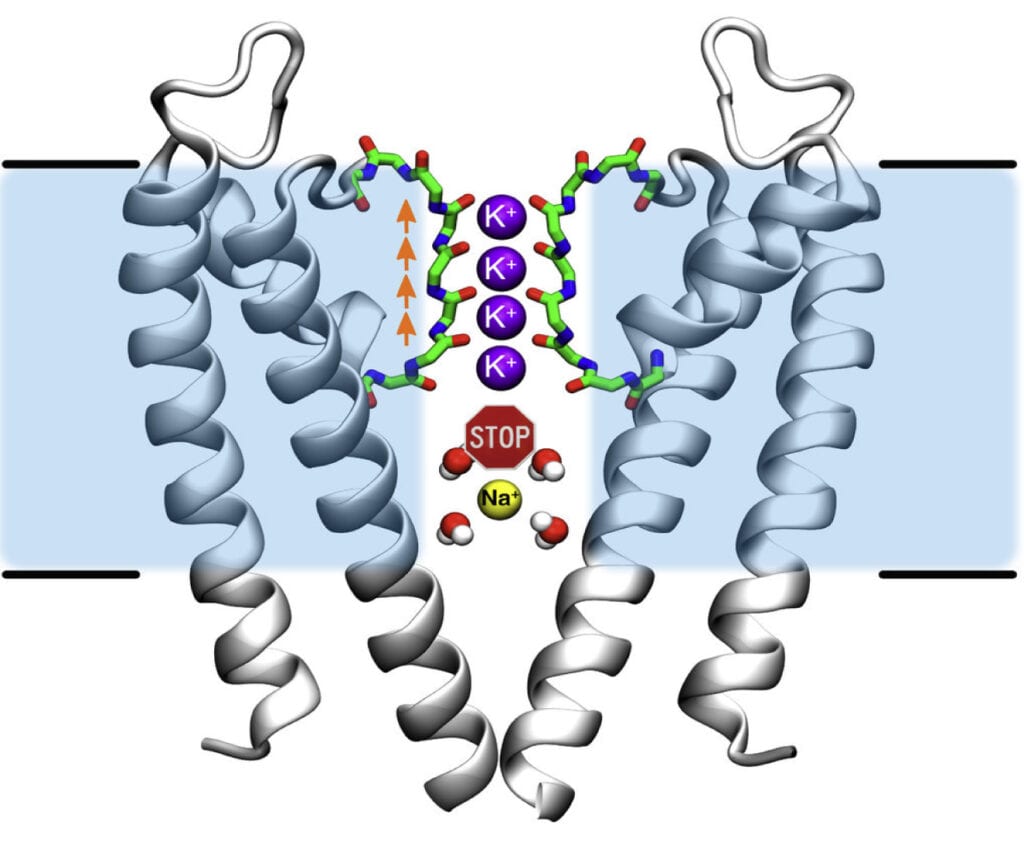
Abb. C. Der schnelle Durchtritt von Kaliumionen und die Ionenselektivität beruhen auf einem gemeinsamen Prinzip. Starke abstoßende Wechselwirkungen zwischen den Kaliumionen ohne Wasserhülle (lila) im Selektivitätsfilter beschleunigen den Durchfluss. Die Bindungsstellen im Selektivitätsfilter (rot) begünstigen dabei die erforderliche räumliche Nähe der Kaliumionen zueinander. Da Natriumionen (gelb) ihre Wasserhülle – anders als Kaliumionen – nicht so leicht ablegen, wird ihr Durchtritt durch den Kanal nicht durch Kanal-Wechselwirkungen gefördert. Zudem sind Natriumionen samt ihrer Wasserhülle für die Pore des Kaliumkanals zu groß.
© W. Kopec, MPI für Multidisziplinäre Naturwissenschaften / CC BY-NC-SA 4.0
Bleibt die Frage nach der Selektivität: Wieso erlauben Kaliumkanäle den Durchfluss von Kaliumionen, während die kleineren Natriumionen zuverlässig ausgeschlossen werden? An der Ladung kann es nicht liegen, denn diese ist bei beiden gleich. Dem Forschungsteam ist es gelungen, auch diese Frage zu beantworten. Wojciech Kopec, Mitglied in der Forschungsgruppe von de Groot erklärt: „Kaliumionen legen ihre Wasserhülle komplett ab, um durch die enge Pore zu gelangen. Natriumionen hingegen behalten ihre Wasserhülle. Damit sind sie letzten Endes größer als ‚entkleidete‘ Kaliumionen – und zu groß für den engen Kaliumkanal-Filter.“ Doch weshalb legen Natriumionen ihre Wasserhülle nicht ebenso ab wie die Kaliumionen? „Die kleineren Natriumionen gehen stärkere Wechselwirkungen mit den Wassermolekülen der Umgebung ein, da ihre Ladung kompakter ist. Daher wäre mehr Energie nötig, um sie von ihrer Wasserhülle zu befreien“, so Kopec. Die Natriumionen passieren die Membran zusammen mit ihrer Wasserhülle. Dies erklärt auch, weshalb die Natriumkanäle fast dreimal breiter als Kaliumkanäle sind.
Schlüsselstellen im Zellgeschehen
Ionenkanäle spielen eine universelle Rolle im „Nachrichtenwesen“ eines Organismus: Ihre Aufgaben reichen von der elektrischen Signalverarbeitung im Gehirn bis zu langsamen Prozessen wie der Salz-Rückgewinnung in der Niere. Wie viele unterschiedliche Ionenkanäle es im menschlichen Körper gibt, hat die Sequenzierung des Humangenoms eindrucksvoll belegt. Dabei stellen Kaliumkanäle unter den Ionenkanälen die größte Proteinfamilie. Sie finden sich in den Membranen der meisten Zelltypen – ein Hinweis auf ihre entscheidende Rolle bei der Weiterleitung von Signalen. Ihre am besten bekannte Funktion ist die Regulation des Membranpotenzials in Nervenzellen, d. h. der Aufbau und die Aufrechterhaltung einer Spannungsdifferenz zwischen dem Inneren und Äußeren einer Zelle. Es gibt sie aber auch in nicht-erregbaren Zellen. Die so genannten ATP-abhängigen Kaliumkanäle beispielsweise finden sich in den meisten Organen und sind mit zahlreichen Stoffwechselvorgängen verknüpft – wie der Insulinausschüttung, der Steuerung des Muskeltonus der Blutgefäße oder der körpereigenen Antworten auf Herzinfarkt oder Schlaganfall. Das Verständnis der Funktion von Ionenkanälen auf molekularer Ebene ist daher Voraussetzung, um Antworten auf wichtige medizinische Fragen zu erhalten. „Wenn wir den molekularen Mechanismus kennen, der den extrem schnellen Durchstrom der Kaliumionen durch den Kanal ermöglicht, können wir zukünftig auch sehr viel besser verstehen, warum sich bestimmte genetische Veränderungen des Ionenkanals so fatal auswirken und zu Krankheiten wie Herzrhythmusstörungen führen können“, so Bert de Groot.
Abbildungshinweise:
Titelbild: © MPG; HN / CC BY-NC-SA 4.0 [4]
Abb. A und A2: Patch-Clamp-Messung © W. Filser, MPG / CC BY-NC-SA 4.0 [4]
Abb. B: Spezialisierte Proteine © MPG; HN / CC BY-NC-SA 4.0 [4]
Abb. C: Schnell und selektiv © W. Kopec, MPI für Multidisziplinäre Naturwissenschaften / CC BY-NC-SA 4.0 [4]
Der Text wird unter CC BY-NC-SA 4.0 [4] veröffentlicht.
BIOMAX 15, aktualisierte Ausgabe Frühjahr 2021; Text: Christina Beck; Redaktion: Tanja Fendt