Geomax 11: Die Reise des Stickstoffs
plus Shipping Costs
Warum wir immer wieder im Grünen baden

Endlich Sommer! Ab geht es ans Meer, an den Strand und rein ins Wasser. Doch dann das: „Algenteppiche vor der Ostseeküste bedrohen Badespaß“, „Rotalge ärgert viele Urlauber – Badeverbote an Hollands Küste“ titeln die Medien. Da macht der Sommerurlaub nur noch halb so viel Spaß, wenn das Meerwasser plötzlich keine einladende Erfrischung mehr bietet. Was ist da los? Woher kommen die pflanzlichen Spaßbremsen und was hat das mit Stickstoff und Bakterien zu tun?
Algen können nach ihrer Größe in zwei Gruppen eingeteilt werden. Zum einen sind das mikroskopisch kleine, frei im Wasser schwebende einzellige Algen, das sogenannte Phytoplankton. Diese Mikroalgen betreiben Fotosynthese und besetzen in der Nahrungskette die Rolle der Produzenten, ähnlich wie die Landpflanzen. Das Phytoplankton ist eine wichtige Nahrungsquelle für Konsumenten wie das Zooplankton, die nur wenig größer sind als die Mikroalgen. Das Zooplankton ist seinerseits wieder Nahrung für größere Tiere. So geht es weiter bis zu großen Fischen und letztlich zu uns Menschen. Die Mikroalgen stehen also am Anfang der marinen Nahrungskette. Zum anderen gibt es größere Algen, die Haftorgane ausbilden, mit denen sie sich an Felsen oder am Meeresboden festhalten können. Ein Beispiel hierfür sind Braunalgen, die oft an den deutschen Stränden zu finden sind. Auch diese größeren Algen sind Nahrung für Meerestiere, bieten aber gleichzeitig auch noch wichtige Versteckmöglichkeiten oder geeignete Orte zum Laichen. Algen sind somit unverzichtbar für das marine Ökosystem. Allerdings können sie zum Problem werden, wenn sie in Massen auftreten (Titelbild), und das hängt mit dem Stickstoff zusammen.
Stoffumbau im marinen Ökosystem
Der Stickstoff im Meer wird hauptsächlich durch mikrobielle Prozesse umgesetzt und dient entweder der Energiegewinnung oder dem Wachstum von Bakterien (Abb. A). Die wichtigste natürliche Quelle von Stickstoff ist die Atmosphäre, die zu 78% aus molekularem Stickstoff (N2) besteht. Nur wenige Mikroorganismen, wie die Cyanobakterien, können molekularen Stickstoff fixieren, indem sie ihn in Ammonium (NH4+) umwandeln (Abb. A, Prozess 1). Bestimmte Bakterien setzen bei ausreichender Sauerstoffversorgung das Ammonium über Nitrit (NO2–) zu Nitrat (NO3–) um (3). Unter anaeroben Bedingungen können andere Bakterien auch Nitrat für ihren Energiestoffwechsel nutzen, wobei in mehreren Schritten letztlich wieder molekularer Stickstoff entsteht (5), der größtenteils als Gas aus dem Meer entweicht. Algen benötigen zum Aufbau zellulärer Moleküle, wie Proteine und Nukleinsäuren, Stickstoff in Form von Nitrat- und Ammonium. Der Stickstoff aus diesen Verbindungen wird in organische Moleküle eingebaut (4). Andererseits wird beim bakteriellen Abbau abgestorbener Algen der „organische“ Stickstoff wieder in die anorganische Verbindung Ammonium umgewandelt (2).
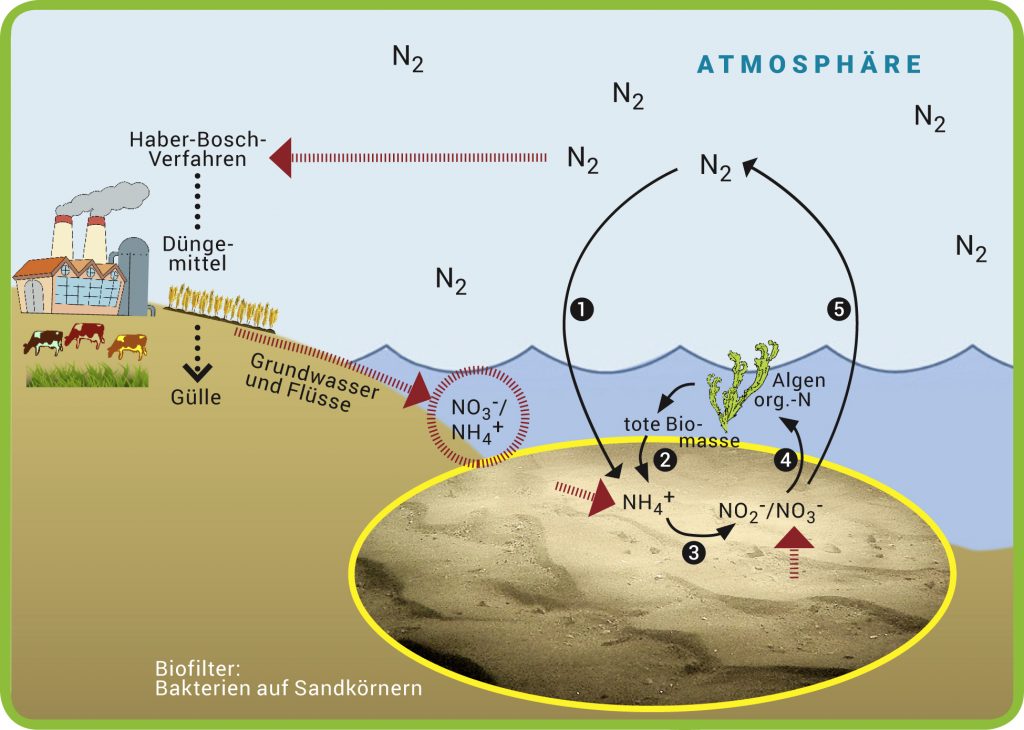
Abb. A: Wege des Stickstoffs. Wichtige Prozesse bei der Umsetzung von Stickstoff im Meer (vereinfacht): (1) Stickstofffixierung, (2) Ammonifikation, (3) Nitrifikation, (4) Assimilation und (5) Denitrifikation. Stickstoff in organischen Verbindungen: „org.-N“. Zusätzliche Stickstoff-Einträge durch menschliche Einflüsse sind rot gekennzeichnet.
© Verändert nach S. Ahmerkamp, MPI für Marine Mikrobiologie / CC BY-NC-SA 4.0
Mangelware oder Überfluss?
Im Meer ist Stickstoff in Form von Nitrat- und Ammoniumionen, die Algen aufnehmen und verarbeiten können, in der Regel Mangelware. Deshalb wachsen Algen normalerweise nur in begrenzter Menge. Doch die stickstoffumsetzenden Prozesse können durch menschliche Einflüsse aus dem Gleichgewicht geraten. Milliarden von Jahren nach den Cyanobakterien ist es Anfang des 20. Jahrhunderts dem Menschen gelungen, durch das Haber-Bosch-Verfahren molekularen Stickstoff aus der Luft chemisch zu fixieren. Der größte Teil des produzierten Ammoniaks wird zur Herstellung von Düngemitteln verwendet. Was auf der einen Seite zur erheblichen Verbesserung der Nutzpflanzenerträge geführt hat, bringt auf der anderen Seite massive Eingriffe in den natürlichen Stickstoffkreislauf mit sich. Mit dem Haber-Bosch-Verfahren werden jährlich inzwischen viele Millionen Tonnen Stickstoff zusätzlich fixiert. Düngemittel sind zusammen mit der Gülle aus der Tierzucht die wichtigsten Quellen des anthropogenen Stickstoffeintrags in die Meere. Regen wäscht überschüssiges Ammonium und Nitrat aus den Böden ins Grundwasser, darüber gelangen die Stickstoffverbindungen in die Flüsse, die sie wiederum ins Meer tragen (Abb. A). So gibt es die Mangelware Stickstoff plötzlich im Überschuss und Ammonium und Nitrat sorgen durch ein starkes Wachstum von pflanzlichem Plankton und anderen Algen für eine „Algenblüte“.
Katerstimmung nach der Fressorgie
Auf den ersten Blick erscheinen die Folgen positiv: Die Algen wachsen in großen Mengen, die Konsumenten haben mehr zu fressen und da die Algen Kohlenstoffdioxid für die Fotosynthese benötigen, entziehen sie das Treibhausgas der Atmosphäre. Doch leider ist das nicht so einfach, denn die Algenblüte hat mehrere unerwünschte Nebenwirkungen. Zum einen können manche Algen unverträgliche oder giftige Stoffe freisetzen, die in großen Mengen Hautreizungen oder Übelkeit verursachen. Deshalb werden oft Badeverbote verhängt, wenn Algenblüten an der Küste auftreten. Ein anderes Problem betrifft die Sauerstoffversorgung im Meer: Die Algen produzieren während des gesteigerten Wachstums zwar jede Menge Sauerstoff, den sie – ähnlich wie die Pflanzen an Land – an die Atmosphäre abgeben. Doch wenn sie absterben, sinkt eine größere Menge an organischem Material nach unten in die tiefen Zonen des Meeres. Dort wird beim bakteriellen Abbau der toten Biomasse so viel Sauerstoff verbraucht, dass Zonen mit starkem Sauerstoffmangel entstehen, in denen Tiere und Pflanzen kaum mehr leben können.
Filter aus Sand
Beim Abbau der Stickstoffverbindungen im Meer ging man lange Zeit davon aus, dass Sande dabei keine Rolle spielen. Soeren Ahmerkamp ist Wissenschaftler am Max-Planck-Institut für Marine Mikrobiologie und erforscht den Mikrokosmos Sandboden. „Das ist besonders faszinierend wegen der überraschend wichtigen Rolle, die der Sandboden für Küstenökosysteme spielt und auch, weil es so kniffelig ist, Untersuchungen direkt vor Ort in so einem dynamischen Lebensraum durchzuführen“, sagt er. Ahmerkamp entwickelte gemeinsam mit einem Team vom Max-Planck-Institut in Bremen ein Messinstrument namens Lance-A-Lot. Die Beobachtungsstation wird auf dem Meeresboden abgestellt und misst dort autonom den Sauerstoffgehalt, die Strömungen und scannt den Boden ab (Abb. B).

Abb. B: Multifunktionaler Helfer. Das Messinstrument erlaubt die gleichzeitige Messung der Strömungsgeschwindigkeit, des Sauerstoffs im Boden und der Bodenform.
© S. Ahmerkamp, MPI für Marine Mikrobiologie / CC BY-NC-SA 4.0
„Wir haben Lance-A-Lot mittlerweile an 30 verschiedenen Stellen in der Nordsee eingesetzt, um den Zusammenhang zwischen Strömung, Bodenform und Sauerstoffgehalt zu untersuchen“, erläutert Soeren Ahmerkamp. Seine Feldbeobachtungen ergänzt er durch Laborversuche und mathematische Modellierungen. Das Forschungsteam konnte zeigen, dass die typischen, an ein Wellblech erinnernden Sandwellen am Meeresboden, die sogenannten Rippel, eine besondere Rolle für den marinen Stickstoffkreislauf spielen. Durch das vorbeiströmende Wasser entsteht zwischen Vorder- und Rückseite der Rippel ein geringer Druckunterschied. Dadurch wird das Meerwasser durch den Sand getrieben und mit ihm Partikel abgestorbener Biomasse, Sauerstoff und Stickstoffverbindungen wie Ammonium oder Nitrat. Die Sandkörner sind mit vielen Mikroorganismen besiedelt (Abb. C). „Die Bakterien sitzen sozusagen auf ihren Sandkörnern und warten bequem darauf, dass die Stoffe über die Strömung zu ihnen transportiert werden“, verdeutlicht der Meeresforscher. Der ständige Stofftransport sorgt dafür, dass die Prozesse im Stickstoffkreislauf besonders effektiv ablaufen und damit auch die Freisetzung von Stickstoff aus dem Meer (vgl. Denitrifikation, Abb. A). So wirkt der Sand an den Küsten wie ein riesiger, bioaktiver Filter. „Sande sind vor allem in küstennahen Bereichen zu finden. Dort verhindern sie, dass Stickstoffverbindungen in das offene Meer gelangen und das Algenwachstum weiter fördern“, sagt Soeren Ahmerkamp. Das gesamte Nitrat können die Mikroorganismen im Sand allerdings nicht umsetzen. Zu viel davon wird von Feldern und anderen Quellen über die Flüsse ins Meer eingetragen. So kommt es regelmäßig zu großen Algenblüten.
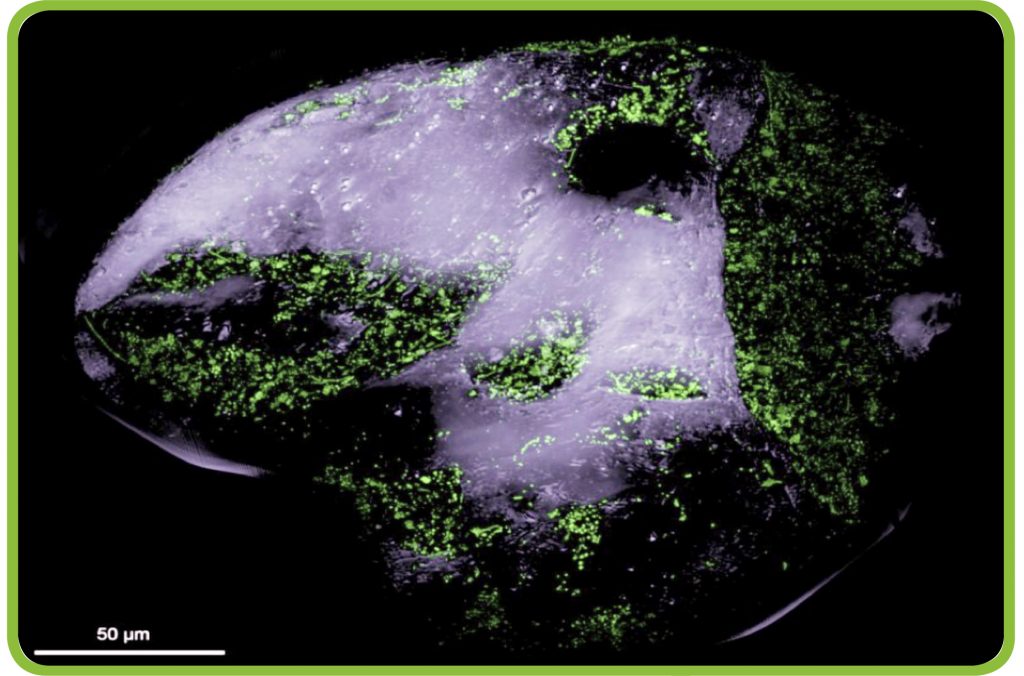
Abb. C: Leben auf einem Sandkorn. Blick auf ein Sandkorn unter dem Fluoreszenzmikroskop: Die grünen Pünktchen sind eingefärbte Bakterien, die sich vor allem in Vertiefungen angesiedelt haben. Zwischen 10.000 und 100.000 Bakterien leben auf jedem einzelnen Korn.
© MPI für Marine Mikrobiologie / CC BY-NC-SA 4.0
Schneeflocken im Meer
Lange wurde angenommen, dass allein die Denitrifikation für die Entfernung von Stickstoffverbindungen aus dem Meer sorgt. Forschende des MPI für Marine Mikrobiologie haben im Jahr 2005 zusammen mit einem Team aus den Niederlanden jedoch gezeigt, dass es noch einen weiteren Vorgang gibt: den Anammox-Prozess. Anammox ist die Abkürzung für anaerobe Ammoniumoxidation und ein weltweit bedeutsamer mikrobieller Prozess des Stickstoffkreislaufs. Nitrit- und Ammoniumionen werden dabei von Anammox-Bakterien in molekularen Stickstoff umgewandelt. Da dieser Prozess anaerob abläuft, konnte er besonders oft in den sogenannten Sauerstoff-Minimumzonen der Meere nachgewiesen werden. Das sind Bereiche im Meer, in denen kein oder nur ganz wenig Sauerstoff vorhanden ist. Da die meisten Tiere und Pflanzen in diesen Bereichen nicht leben können, werden sie auch Todeszonen im Meer genannt. Sie sind an sich ein natürliches Phänomen, können aber durch menschlichen Einfluss verstärkt werden, wie vielerorts nachgewiesen wurde. Die größten Sauerstoff-Minimumzonen liegen vor der Küste Südamerikas im Pazifik. Es gibt sie aber auch in der Ostsee.
Viele Einzelheiten des Anammox-Prozesses sind nach wie vor ungeklärt. Das Team am MPI für Marine Mikrobiologie untersucht zum Beispiel den Zusammenhang zwischen dem Abbau von organischem Material und dem Anammox-Prozess. In den produktiven Zonen des Meeres gibt es einen ständigen Niederschlag an toter Bio-masse, den sogenannten ‚Marine Snow‘. Dieser marine Schnee verhält sich wie richtiger Schnee: Große Flocken sind seltener und fallen schnell, kleine Flöckchen kommen sehr oft vor und rieseln langsam. Die Forscherinnen und Forscher haben jetzt herausgefunden, dass es diese beiden Eigenschaften sind, die kleinen Partikeln eine große Bedeutung für die Regulierung des Mineralstoffhaushalts der Meere verleihen.
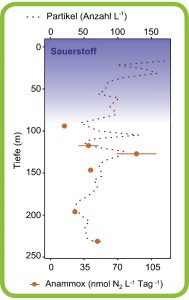
Abb. D: Kleine Teilchen, große Wirkung. Anammox-Bakterien leben in Sauerstoff-Minimumzonen (O2-Gehalt: blauer Gradient) und wandeln Ammonium und Nitrit zu N2-Gas um. Sie nutzen das Ammonium in kleinen, absinkenden Partikeln (rote gestrichelte Linie). In Bereichen mit vielen Partikeln sind die Anammox-Bakterien besonders aktiv. Die orangen Kreise stehen für die Menge an N2-Gas, die sie in der jeweiligen Wassertiefe produzieren.
© C. Karthäuser, MPI für Marine Mikrobiologie / CC BY-NC-SA 4.0
Dabei haben die Wissenschaftlerinnen und Wissenschaftler das Rätsel gelöst, wie die in den Partikeln gebundenen Stoffe zu den frei in der Wassersäule lebenden Anammox-Bakterien gelangen. Sie nahmen in der Sauerstoff-Minimumzone vor Peru mit Unterwasserkameras an verschiedenen Stationen Tiefenprofile auf, um zu sehen, wie viele Partikel es jeweils gab. „Wir haben beobachtet, dass der Anammox-Prozess vor allem da stattfindet, wo viele kleine Partikel vorhanden sind“, sagt Clarissa Karthäuser, die zusammen mit Soeren Ahmerkamp die Zusammenhänge erforscht. Die kleinen Partikel mit einer Größe von 0,1 mm kommen in der Wassersäule sehr oft vor, sinken nur langsam und haben dadurch lange Aufenthaltszeiten (Abb. D). Gleichzeitig ist das organische Material bei ihnen enger verklebt. Dadurch transportieren kleinere Partikel ähnlich viel Material wie die größeren Partikel, also auch deutlich mehr gebundenen Stickstoff. „Mit einem Modell konnten wir zeigen, dass die Ammonium-Konzentration in der Grenzschicht, das heißt, um das Partikel herum, deutlich erhöht ist“, sagt Ahmerkamp. „So ist es erstens durch die hohe Anzahl und langen Aufenthaltszeiten von kleinen Partikeln in der Wassersäule sehr wahrscheinlich, dass Bakterien zufällig auf sie treffen. Zweitens werden durch die hohe Ammoniumkonzentration in der Grenzschicht schnell viele Bakterien versorgt.“ Die Anammox-Bakterien entfernen große Mengen an Stickstoffverbindungen aus dem Meer, indem sie diese zu molekularem Stickstoff umsetzen. Etwa die Hälfte der im Meer produzierten Menge an N2 gelangt über diesen Weg in die Atmosphäre. So spielt der Anammox-Prozess eine wichtige Rolle bei der Regulierung des marinen Stickstoffhaushalts.
Klimaschädliche Gase
Bei der Denitrifikation entsteht allerdings nicht nur Stickstoffgas (N2). Es werden auch kleine Mengen an Lachgas (N2O) gebildet, das wie der Stickstoff aus dem Wasser in die Atmosphäre entweicht. Stickstoffgas ist für das Klima der Erde nicht relevant, Lachgas dagegen ist klimaschädlich, und zwar weitaus mehr als CO2. Es verstärkt den Treibhauseffekt und schädigt die Ozonschicht. „Die Überlegung, dass die Sande alle eingetragen Stickstoffverbindungen entfernen und so verhindern, dass sie in den offenen Ozean gelangen, stimmt nur zum Teil. Die Sande setzen zwar viele, aber nicht alle Stickstoffverbindungen um, und der Preis dafür ist, dass dabei Lachgas frei wird“, erklärt Ahmerkamp. Auch das verstärkte Algenwachstum durch die zusätzlichen Stickstoffverbindungen hat zwei Seiten: Ein großer Teil des CO2, das die Algen bei der Fotosynthese aufnehmen, wird bei der mikrobiellen Zersetzung der abgestorbenen Algen wieder zurück in die Atmosphäre abgegeben und dadurch nicht langfristig gebunden.
Der Blick auf den marinen Stickstoffkreislauf zeigt, dass es keine schnelle Lösung für das Problem der immer wieder auftretenden Algenblüten gibt. Solange zu viele Stickstoffverbindungen in die Meere gelangen, werden auch die Algen wuchern, das marine Ökosystem gefährden und uns immer wieder das Badevergnügen vermiesen. Um etwas zu ändern, müssen die Ursachen der erhöhten Ammonium- und Nitratwerte angegangen werden. Ein großer Teil des Stickstoffeintrags in die Gewässer erfolgt durch die Landwirtschaft, daher könnten ein effizienterer Einsatz von Düngemitteln oder eine stickstoffreduzierte Fütterung von Nutztieren zur Verminderung der Nitratwerte beitragen. Die Nitrat-Richtlinie der EU zeigt auch, wie wichtig es ist, die zu hohen Nitratwerte länderübergreifend zu senken. Bis dahin müssen wir damit rechnen, beim Strandurlaub statt in schönen Wellen nur im Schwimmbad Abkühlung zu bekommen.
Abbildungshinweise:
Titelbild: © iStockphoto.com
Abb. A: © Verändert nach S. Ahmerkamp, MPI für Marine Mikrobiologie / CC-BY-NC-SA 4.0
Abb. B: © S. Ahmerkamp, MPI für Marine Mikrobiologie / CC-BY-NC-SA 4.0
Abb. C: © MPI für Marine Mikrobiologie / CC-BY-NC-SA 4.0
Abb. D: © C. Karthäuser, MPI für Marine Mikrobiologie / CC-BY-NC-SA 4.0
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
GEOMAX 11, Sommer 2021; Autorin: Katrin Matthes; Redaktion: Tanja Fendt


