Techmax 15: Schärfer als das Licht erlaubt
plus Shipping Costs
Forschung überwindet die Grenzen der Lichtmikroskopie
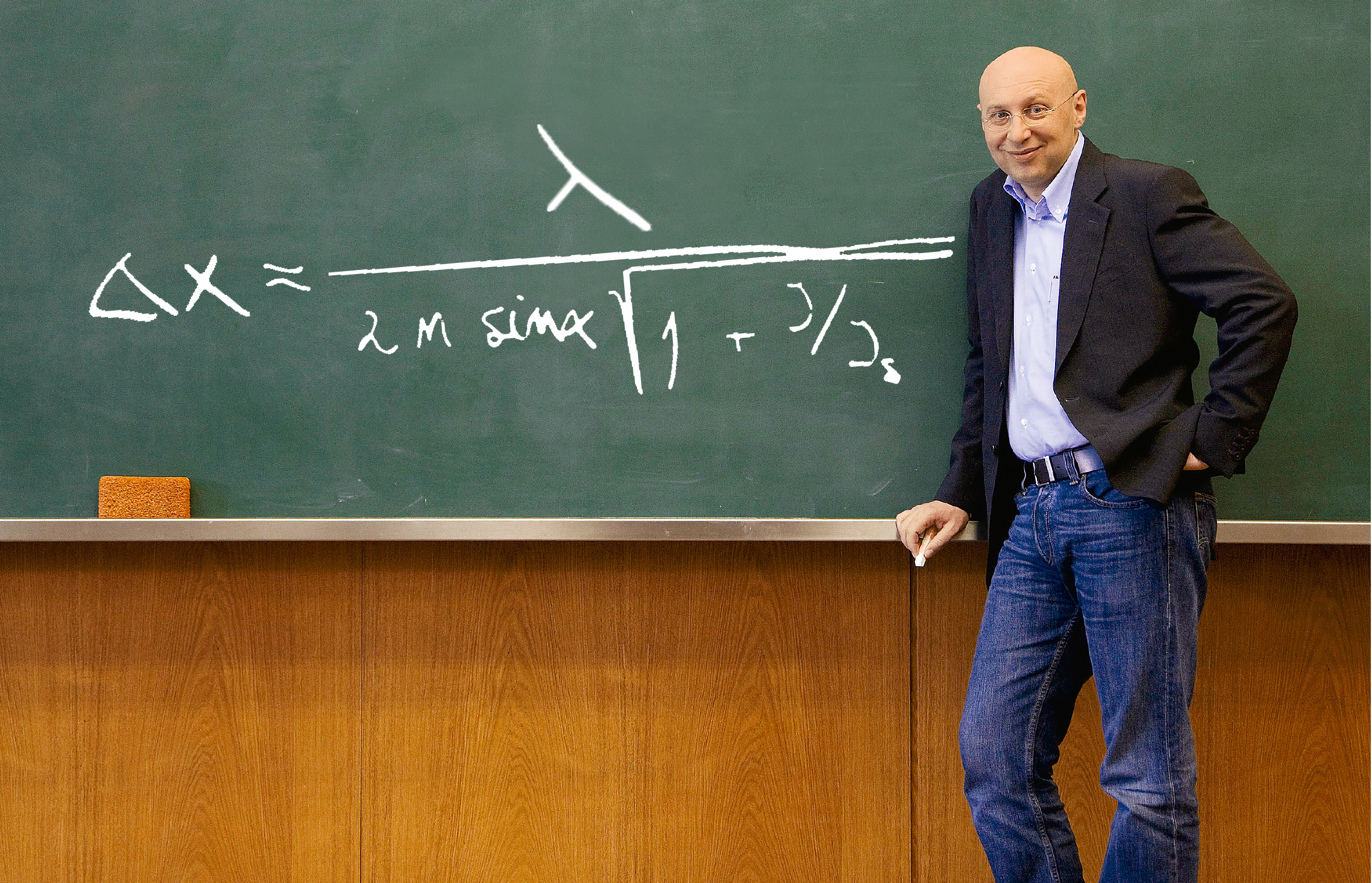
Stefan Hell hat in den Nenner der Abbeschen Formel den Wurzelterm eingeführt. Demnach verkleinert sich Δx, der Abstand zwischen zwei gerade noch zu unterscheidenden Punkten, wenn die Intensität I des Lasers steigt, der die Emission der angeregten Fluoreszenzmoleküle induziert. So kann man berechnen, wie weit sich die Auflösungsgrenze senken lässt.
© Deutscher Zukunftspreis / Ansgar Puden
Im 16. Jahrhundert notierte der italienische Arzt Girolamo Fracastoro, dass zwei hintereinander angeordnete optische Linsen ein Objekt näher und vergrößert erscheinen lassen sollten. Damit beschrieb er wahrscheinlich zum ersten Mal ein Mikroskop. Optische Linsen kannte man damals schon als Brille. Fracastoros Idee, sie gezielt zur Vergrößerung kleiner Gegenstände einzusetzen, war jedoch neu. Es sollte aber noch bis zum Anfang des 17. Jahrhunderts dauern, bis die ersten Lichtmikroskope gebaut wurden. Wann das genau geschah, ist unklar. Historisch gesichert ist jedenfalls, dass der niederländische Brillenmacher Hans Janssen und sein Sohn Zacharias im Jahr 1608 auf der Frankfurter Messe ein Mikroskop vorführten. Ein Jahr später präsentierte Galileo Galilei in Rom sein erstes Gerät.
Allerdings waren diese frühen Lichtmikroskope kaum brauchbar, denn sie litten unter fehlerhaften Linsen. Der Durchbruch gelang erst dem Niederländer Antonie van Leeuwenhoek mit einem radikal vereinfachten Design: Sein Mikroskop bestand nur aus einer einzigen Linse, es war also eigentlich eine Hochleistungslupe. Dafür hatte van Leeuwenhoek diese Linse mit einer zuvor unerreichten Präzision geschliffen. Bei fast 300-facher Vergrößerung entdeckte der Niederländer die damals völlig unbekannte Welt der Mikroben. Die Menschheit verdankt dem Lichtmikroskop einen gigantischen Zuwachs an Wissen über unsere Welt. Ohne Mikroskopie wäre zum Beispiel die moderne Medizin nicht denkbar.
Im 19. Jahrhundert wurden die Lichtmikroskope immer leistungsfähiger. Doch stieß ihre Technik an eine Grenze: Die Vergrößerung ließ sich nicht beliebig steigern. Der Jenaer Physikprofessor Ernst Abbe und der englische Physiker Baron Rayleigh erkannten fast zur gleichen Zeit: Sobald feine Objektdetails ungefähr so eng beieinander sitzen wie es der Wellenlänge des Lichts entspricht, kann ein Mikroskop sie nicht mehr voneinander getrennt abbilden. Schuld daran sind die Welleneigenschaften des Lichts. Eine Optik kann es nicht unendlich scharf bündeln: Die Brennpunkte der Strahlen blühen unweigerlich zu „Brennflecken“ auf. Diese Flecken sind mindestens eine halbe Wellenlänge des eingesetzten Lichts groß. Alle feineren Strukturen innerhalb dieser Flecken sind im Mikroskopbild nicht mehr erkennbar.
Ernst Abbe begründete 1873 wissenschaftlich präzise, dass die Auflösung eines optischen Mikroskops nie über die „halbe Wellenlänge des blauen Lichts um ein Nennenswertes hinausgehen wird“. Blaues Licht hat die kürzeste Wellenlänge im sichtbaren Spektrum, die Hälfte davon entspricht rund 200 Nanometern (Milliardstel Meter). Wegen dieses „Abbe-Limits“ können Lichtmikroskope Objekte, die kleiner sind, nicht mehr abbilden. Dazu gehören zum Beispiel die meisten Viren. Es gilt auch für alle Moleküle des Lebens, selbst wenn viele davon außerordentlich groß sind. Besonders für die Biowissenschaften musste es demnach ein schöner Traum bleiben, durch das Mikroskop den Tanz der Moleküle in lebenden Zellen – also live – enträtseln zu können.
Abbes Theorie bietet praktisch nur eine Möglichkeit, die Auflösung eines Mikroskops zu steigern: Man verkürzt die Wellenlänge des Lichts. Leider wird aber das Glas der Linsen schon für ultraviolettes Licht undurchsichtig. Daran scheiterte eine weitere Steigerung der optischen Auflösung von Lichtmikroskopen. Erst im 20. Jahrhundert zeigte die aufkommende Quantenphysik einen Ausweg auf: Teilchen sind zugleich Wellen, und Elektronen sind wesentlich kurzwelliger als Licht. Zudem lassen sich die Strahlen solcher elektrisch geladenen Teilchen mit „Linsen“ aus elektrischen und magnetischen Feldern fokussieren. So konnten Elektronenmikroskope die Nanowelt erschließen und sogar einzelne Atome abbilden. Allerdings benötigen sie meistens Vakuum und mit Metall bedampfte Proben. Das überlebt keine Zelle. Inzwischen gibt es zwar schonendere Verfahren, aber auch diese eignen sich nicht für lebende Objekte. So musste die Forschung akzeptieren, dass sie molekulare Details nur an toten Präparaten untersuchen kann. Damit kann sie aber die komplizierten Lebensprozesse nur mühsam auf indirekte Weise entschlüsseln.
Lange galt das Abbe-Limit als ultimative Grenze der Lichtmikroskopie – genauer gesagt, der Fernfeld-Mikroskopie. Fernfeld heißt, dass das Objektiv des Mikroskops viele Lichtwellenlängen vom Objekt entfernt ist. Tatsächlich konnte die sogenannte Nahfeld-Mikroskopie in den 1980er-Jahren erstmals das Abbe-Limit bei sichtbarem Licht durchbrechen. Sie rückt mit einer Präzisionssteuerung eine spitzenförmige Optik auf wenige Nanometer an das Objekt heran – also viel weniger als die Lichtwellenlänge. Allerdings sind ihre Abbildungseigenschaften kompliziert und kaum auf Zellen und Gewebe anwendbar. Deshalb blieb die optische Nahfeld-Mikroskopie eine Spezialanwendung.
Jenseits der Abbe-Grenze
Die Abbe-Grenze der Fernfeld-Mikroskopie durchbrach erst Ende der 1990er-Jahre ein junger deutscher Physiker erfolgreich. Wer mit Stefan Hell, Direktor am Max-Planck-Institut für Multidisziplinäre Naturwissenschaften in Göttingen, darüber spricht, hört eine Lebensgeschichte, die eines lehrt: Auch in den Naturwissenschaften muss man grundlegend neue Ideen oft mit Mut, Optimismus und großer Zähigkeit durchsetzen. Hell hat diese Steherqualität. Als er als junger Physiker zunächst in Heidelberg versuchte, etablierte Wissenschaftler von seinen Ideen zu überzeugen, scheiterte er. „Das war einfach zu radikal“, sagt Hell im Rückblick. Schließlich bekam er 1997 am Göttinger Max-Planck-Institut die Chance, als Nachwuchswissenschaftler seine Idee zu verwirklichen. Nach drei Jahren war klar, dass es tatsächlich funktioniert. Heute ist Hell ein international berühmter Wissenschaftler: 2014 erhielt er für seine Entdeckung den Nobelpreis für Chemie, gemeinsam mit den US-Amerikanern Eric Betzig und William Moerner. Wie aber funktioniert seine radikal neue Idee?
Um das zu verstehen, müssen wir nochmals zurück in das 19. Jahrhundert und Ernst Abbe über die Schulter schauen. Abbe experimentierte damals mit Beugungsgittern. Diese Glasplättchen mit ihren sehr feinen, parallel eingeritzten Linien gehören heute zum Schulunterricht in Physik. Damals waren sie wissenschaftliches Neuland. Der Abstand der Linien liegt im Wellenlängenbereich von sichtbarem Licht, also bei einigen Hundert Nanometern. Fällt Licht durch so ein Gitter, dann bricht es dessen parallele Wellenfront in kleine Kreiswellen auf. Diese wandern in den Raum jenseits des Gitters. Steht dort ein Leuchtschirm, dann überlagern sie sich auf ihm zu einem hellen Fleck in der Mitte und einer Reihe kleinere Lichtflecken links und rechts (Abb. A).
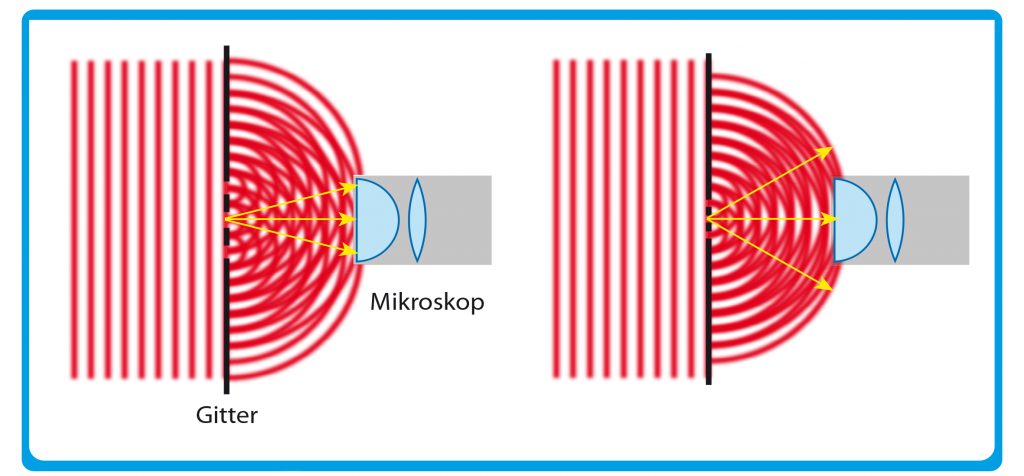
Abb. A: Abbesche Auflösungsgrenze von Fernfeld-Lichtmikroskopen. Von links fällt eine ebene Lichtwelle auf ein Beugungsgitter als Objekt, das hier drei Öffnungen hat. In den Öffnungen bricht die Lichtwelle in einzelne Kreiswellen auf. Diese überlagern sich auf dem Weg zur Öffnungslinse des Mikroskops. In den Maxima tun sie das konstruktiv, dazwischen löschen sie sich aus. Die gelben Pfeile deuten die Positionen des Hauptmaximums und der beiden ersten Nebenmaxima an. Letztere fängt das Objektiv im linken Fall gerade noch ein, das Mikroskop bildet das Gitter erkennbar ab. Bei engerem Gitter und unveränderter Wellenlänge des Lichts (rechts) spreizen die Nebenmaxima sich zu weit für das Objektiv auseinander. Das Mikroskopbild enthält keine Information mehr.
© R. Wengenmayr / CC BY-NC-SA 4.0
Dieses sogenannte Beugungsbild enthält die Bildinformation über das Gitter. Abbe erkannte, dass man mindestens die beiden ersten Flecke, die „Nebenmaxima“ neben dem Hauptfleck, als Information braucht, damit das Bild das Aussehen des Beobachtungsobjekts erkennbar wiedergibt. In diesem Fall wäre das Objekt also das Beugungsgitter. Je näher dessen Gitterlinien zusammenrücken, je feiner es wird, desto weiter spreizen sich aber die Nebenmaxima auseinander. Abbe fand, dass dieser Zusammenhang nicht nur für optische Gitter gilt, sondern für alle Beobachtungsobjekte. Daraus folgerte er: Die Objektivöffnung eines Mikroskops, die Apertur, muss grundsätzlich die ersten Nebenmaxima des am Beobachtungsobjekt gebeugten Lichts erfassen können. Nur dann enthält das Mikroskopbild eine Mindestinformation über das Objekt. Ansonsten sieht man im Okular nur gleichförmige Helligkeit.
Stefan Hell war klar, dass er dieses grundlegende Gesetz der Wellenoptik nicht aushebeln konnte. Stattdessen konzentrierte er sich auf die Beobachtungsobjekte. Und hier konnte er eine Besonderheit der Biowissenschaften ausnutzen. Ernst Abbes Beugungsgitter werden – wie auch viele Objekte unter dem Mikroskop – passiv von einer Lichtquelle beleuchtet. In der biomedizinischen Forschung werden interessante Moleküle aber mit einem fluoreszierenden Farbstoff als Marker versehen – sie leuchten also selbst aktiv. Fluoreszenz heißt, dass eine Lichtquelle die Farbstoffmoleküle dazu anregt, selbst wie winzige Nano-Lampen in einer charakteristischen Farbe, also Wellenlänge, zu leuchten. Und das funktioniert auch in lebenden Zellen.
„Proteine zum Beispiel kann man optisch nur unterscheiden, wenn sie an einen Farbstoff gebunden sind“, begründet Hell die Bedeutung dieser Methode. Er kam auf die Idee, mit Hilfe dieser molekularen Lampen die Abbesche Beugungsgrenze zu durchbrechen. Seine Basis war eine bereits etablierte Mikroskoptechnik, bei der ein sehr scharf gebündelter Laserstrahl die Probe abrastert. Sie erzeugt so Punkt für Punkt ein Bild. Diese Technik erreicht eine besonders hohe Auflösung. Sie unterliegt aber noch dem Abbe-Limit: Die Optik lässt den Laserstrahl durch Beugung an ihrer Öffnung auf mindestens den 200-Nanometer-Fleck aufblühen. In diesem Fleck fluoreszieren alle dort befindlichen Farbstoffmoleküle. Ihre Nano-Leuchtpunkte verschwimmen im Mikroskopbild zu einem gemeinsamen Punkt.
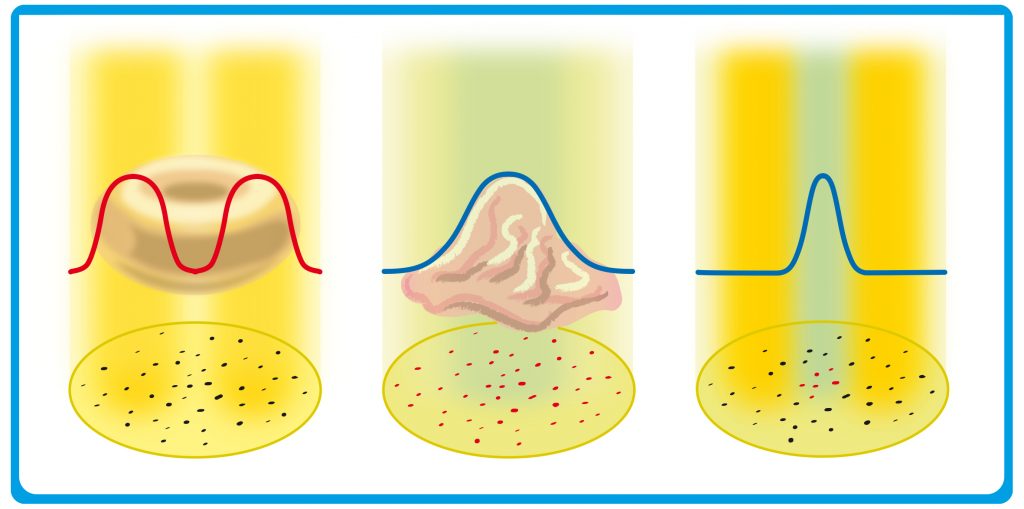
Abb. B: STED-Mikroskop. Der Laserstrahl rastert eine Probe mit Farbstoffmolekülen (Punkte unten) ab. Der ausgeleuchtete Fleck ist wegen der Abbe-Grenze immer mindestens 200 Nanometer breit. Links: Der Ausschaltestrahl hat ein Profil der Lichtintensität wie ein Donut. Er unterdrückt die Fluoreszenz der Moleküle (blau). Mitte: Das breite Profil des Einschaltestrahls erinnert an eine zerlaufende Eiskugel, er lässt alle Farbstoffmoleküle im ausgeleuchteten Fleck fluoreszieren (rot). Rechts: Beide Strahlen sind überlagert und lassen die Moleküle auf einem Fleck leuchten, der nun viel kleiner als 200 Nanometer ist.
© R. Wengenmayr / CC BY-NC-SA 4.0
Damit wäre also noch nichts gewonnen. Nun aber kommt Hells Idee ins Spiel, und die klingt verblüffend einfach: „Man muss die fluoreszierenden Moleküle einfach in einem größeren Bereich des Beleuchtungsflecks dunkel schalten“, sagt der Physiker, „dann bekommt man eine höhere Auflösung.“ Dieses „Ausknipsen“ der meisten leuchtenden Moleküle im äußeren Ring des Flecks ist der entscheidende Trick: Nur in einem sehr schmalen Bereich in der Mitte des Strahls leuchten dann noch Moleküle (Abb. B). Dieser „Restbereich“ lässt sich so klein machen, dass „es nach unten eigentlich keine Grenze gibt“, sagt Hell. „Und bei den Molekülen, die im Lichtfleck noch angeregt sind“, fährt er fort, „weiß ich genau, wo die sind.“
Von Rasterpunkten zu Bildern
Die Information über den präzisen Ort der noch leuchtenden Moleküle liefert die Position des Laserstrahls. Das ermöglicht die moderne Scannertechnik, wie sie auch in den berühmten Rastertunnel–Mikroskopen eingesetzt wird. Die Position des Laserstrahls steuern Piezokristalle, die elektrische Signale ultrapräzise in winzigste mechanische Bewegungen umwandeln, auf Nanometer genau. So lassen sich die Rasterpunkte am Computer tatsächlich zu einem lichtmikroskopischen Bild zusammensetzen, das nur wenige Nanometer kleine Strukturen scharf abbildet (Abb. C). Es ist damit viel schärfer, als es das Abbesche Beugungslimit erlauben würde. Sogar Videosequenzen sind möglich.
Abb. C: Der Laserstrahl rastert die Probe ab.
© R. Wengenmayr / CC BY-NC-SA 4.0
Nun ist noch die Frage offen, wie das Dunkelschalten der Farbstoffmoleküle funktioniert. Dabei hilft die Quantenphysik. Im einfachsten Fall ist es ein Effekt, den Albert Einstein 1917 vorhersagte. Er heißt stimulierte Emission. Atome und Moleküle besitzen erlaubte Quantenzustände, in denen sich Elektronen einer bestimmten Wellenlänge aufhalten dürfen. Da Wellenlänge und Energie in der Quantenwelt direkt miteinander verknüpft sind, bilden diese Quantenzustände eine „Energietreppe“ für Elektronen. Fällt ein Elektron von einem höheren Zustand, sozusagen einer höheren „Stufe“, in einen niedrigeren Zustand näher am Atomkern, dann setzt es Energie in Form eines Lichtquants (Photon) frei. Dessen Wellenlänge passt exakt zur Energie des Quantensprungs. Dieser Vorgang heißt Emission und passiert immer dann, wenn Materie leuchtet. Normalerweise fallen die Elektronen irgendwann zufällig auf die untere Stufe. Bei der stimulierten Emission jedoch rüttelt ein vorbeifliegendes Photon mit exakt passender Wellenlänge an einem Elektron auf der höheren Stufe und lässt es auf die tiefere Stufe der Energietreppe fallen (siehe TECHMAX, Ausgabe 6). Die Anregungsenergie des Moleküls nimmt ein dabei erzeugtes Zwillingsphoton mit.
Schalter für Nanolampen
Das Prinzip Zwillingsphotonen zu erzeugen, nutzt der Laser. Stefan Hell allerdings setzt es genau für das Gegenteil ein: Bei ihm sorgt ein Laserstrahl für einen prasselnden Regen an Photonen auf den 200-Nanometer-Lichtfleck. Ihre Wellenlänge passt exakt zu dem Quantensprung, mit dem die Elektronen wieder in den Grundzustand gebracht werden können. Mit dieser stimulierten Emission werden die fluoreszierenden, also spontan leuchtenden Farbstoffmoleküle einfach „ausgeknipst“. Nur auf einem engen Fleck in der Mitte bleiben sie verschont, so dass sie ungestört fluoreszieren können.
Während also ein erster energiereicher Lichtstrahl für die Anregung der Fluoreszenzmarker sorgt, wird ein zweiter eingesetzt, um die angeregten Fluoreszenzmarker wieder abzuregen, bevor sie Fluoreszenzlicht emittieren. Der Vorgang nennt sich Fluoreszenzlöschung (englisch Quenching). Der Trick, um die höhere Auflösung zu erreichen, besteht darin, diesen zweiten Strahl ringförmig über den ersten zu legen (Abb. B). Dadurch werden vor allem Marker aus dem Außenbereich des ersten Strahls abgeregt, und die Fläche des Fluoreszenzflecks verkleinert sich. Dort können die Fluoreszenzmoleküle noch immer ungestört leuchten. Das Lichtfeld der beiden ineinander geschachtelten Strahlen erinnere an „einen Donut“, schmunzelt Hell. Dabei lässt sich das Loch in der Mitte beliebig klein machen – es unterliegt nicht mehr dem Abbe-Limit. Auf diese Weise haben die Forschenden inzwischen eine Auflösung von unter zehn Nanometern erreicht – und damit die vermeintliche Auflösungsgrenze der Lichtmikroskopie um mehr als das Zehnfache unterboten.
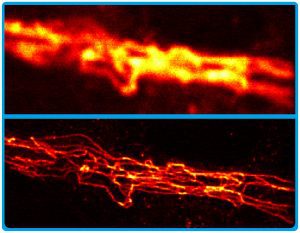
Abb. D: Blick ins Zellinnere. Die Bilder zeigen Filamente von Vimentin in einer Zelle. Das Protein ist ein Element des Zellskeletts von Wirbeltieren. Das obere Bild wurde konventionell aufgenommen, das untere mit einem STED-Mikroskop, das die Beugungsgrenze der klassischen Lichtmikroskopie durchbricht.
© MPI für Multidisziplinäre Naturwissenschaften
Hells Gruppe gelangen so erstmals faszinierende Bilder zum Beispiel von Filamenten des Zellskeletts (Abb. D). Der Max-Planck-Forscher hat seine Methode „STED-Mikroskop“ getauft. STED steht dabei für das englische Stimulated Emission Depletion. Derzeit entstehen immer neue Varianten des Verfahrens. Sie nutzen andere Quanteneffekte zum „Dunkelschalten“ der Farbstoffmoleküle. Längst gibt es kommerzielle Versionen des STED-Mikroskops und seiner Weiterentwicklungen, auch vom Göttinger Start-up Abberior, das der Nobelpreisträger mit gegründet hat. Einst entdeckte van Leeuwenhoek die Welt der Mikroben mit seinen Mikroskopen. Und Stefan Hells Erfindung vermittelt uns heute neue, tiefe Einsichten in die Nanowelt des Lebens.
Abbildungshinweise:
Titelbild © Deutscher Zukunftspreis / Ansgar Puden
Abb. A-C © R. Wengenmayr / CC BY-NC-SA 4.0
Abb. D: © MPI für Multidisziplinäre Naturwissenschaften
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
TECHMAX Ausgabe 15, aktualisiert im Frühjahr 2023; Autor: Roland Wengenmayr; Redaktion: Tanja Fendt


