2050 will Europa der erste klimaneutrale Kontinent sein und – gemäß des „Green New Deal“ der Europäischen Kommission (s. Geomax 29) – bereits bis zum Jahr 2030 die Netto-Treibhausgas-Emissionen um 55 Prozent gegenüber 1990 gesenkt haben. Das betrifft vor allem den Kohlenstoffdioxidausstoß, denn CO2 ist mit fast 90 Prozent mengenmäßig das bedeutendste klimaschädliche Gas. Um auf fossile Brennstoffe wie Kohle, Öl und Erdgas dann weitgehend verzichten zu können, muss vor allem die Industrie neue Wege gehen, sowohl für die Energieversorgung als auch für die Rohstoffbasis der chemischen Industrie. Eine gewaltige Herausforderung – für die es aber raffinierte Lösungen gibt. Zum Beispiel „Carbon2Chem“: Aus Abgas werde Rohstoff!
Im Jahr 2022 lag der Kohlenstoffdioxid-Anteil in der Luft bei rund 417 ppm und damit rund 40 Prozent höher als in vorindustrieller Zeit. Das Gas gehört zur natürlichen Atmosphäre der Erde, denn es entsteht seit Urzeiten als Nebenprodukt bei der Zellatmung der meisten Lebewesen, beim Zerfall toter Organismen und wird außerdem bei Vulkanausbrüchen freigesetzt. Den kontinuierlichen Ausstoß kompensieren Prozesse, die Kohlenstoffdioxid in großem Maßstab verbrauchen, wie die Fotosynthese von grünen Pflanzen und bestimmten Bakterienarten. Oder solche, die CO2 speichern, wie die Ozeane, Wälder und Moore es tun. Auch die Bildung von Erdöl, Erdgas und Kohle aus abgestorbenem organischem Material verringert den CO2-Gehalt der Erdatmosphäre. Doch durch die massenhafte Verbrennung dieser fossilen Energieträger wurde das sensible Gleichgewicht gestört. Und so steigt der CO2-Gehalt der Atmosphäre mit zunehmender Industrialisierung rund um den Globus stetig weiter an (s. Geomax 22).
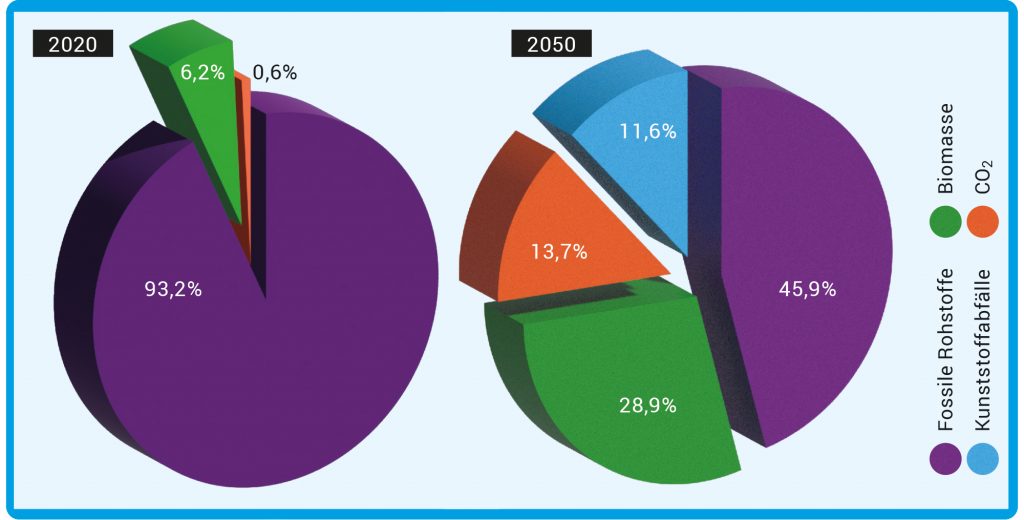
Abb. A: Mögliche Rohstoffbasis der Zukunft. Nach einer Modellrechnung könnte bis 2050 die Chemieindustrie in Deutschland 61 Prozent weniger Treibhausgase gegenüber 2020 freisetzen. Dafür ist mit einem rund vierfachen Strombedarf im Jahr 2050 zu rechnen. Nötig wären hohe Investitionen für neue Verfahren, und auch die Rohstoffbasis müsste massiv umgebaut werden: Biomasse, Kunststoffabfälle und CO2 müssten mehr als die Hälfte der fossile Rohstoffe ersetzen. Möglich wäre auch die Senkung der Emissionen auf nahe Null – mit einem entsprechend höheren Bedarf an Strom usw.. Zur Vergleichbarkeit der verschiedenen Rohstoffe werden in den Diagrammen die eingesetzten Mengen auf den Kohlenstoffgehalt bezogen.
© Quelle: DECHEMA & FutureCamp: ROADMAP CHEMIE 2050. 2019, S. 76. ISBN: 978-3-89746-223-6
In Deutschland sind seit 1990 die Treibhausgasemissionen fast kontinuierlich um 46 Prozent gesunken: von 1.251 auf 674 Millionen Tonnen pro Jahr. Nach der Energiewirtschaft hat die Industrie den zweitgrößten Anteil daran. Vor allem zwischen 2018 und 2023 war ein deutlicher Rückgang zu verzeichnen – bedingt durch den geringeren Einsatz fossiler Brennstoffe, insbesondere von Erdgas und Steinkohle. Doch das reicht bei weitem nicht aus. Zudem beruht die Rohstoffbasis der chemischen Industrie noch immer zu über 90 Prozent auf fossilen Quellen, was sich für eine deutliche Reduktion der Treibhausgase bis 2050 drastisch ändern müsste (Abb. A).
Ließe sich das eine nicht mit dem anderen kompensieren? Industriell anfallendes klimaschädliches CO2 als Quelle für Rohstoffe nutzen und somit in die Wertschöpfungskette zurückführen? Genau das wird im Rahmen von Carbon2Chem erforscht – einem Grundstein künftiger „Carbon Capture and Use Technologien“ (CCU). Carbon2Chem ist ein Verbundprojekt des Stahlkonzerns thyssenkrupp, des Max-Planck-Instituts für Chemische Energiekonversion sowie des Fraunhofer-Instituts für Umwelt-, Sicherheits- und Energietechnik und 14 weiteren Partnern. In der Pilotanlage auf dem Gelände des größten Stahlwerks Europas in Duisburg filtern die Forschenden aus den Hochofenabgasen Kohlenstoffmonoxid und -dioxid heraus, führen es mit Wasserstoff zusammen und erzeugen in einer katalytischen Reaktion daraus Methanol.
Warum gerade Methanol? Das hat mehrere Gründe. Zum einen lassen sich aus dem kleinsten Alkoholmolekül leicht weitere chemische Grundstoffe herstellen. Zum anderen kann Methanol direkt als Kraftstoff genutzt werden. Nicht nur für Autos, wie etwa in Brasilien, sondern auch für Mobilität in Bereichen, in denen Elektroantriebe noch keine Alternative sind – zum Beispiel bei XXL-Containerschiffen. Die 350 Meter lange, 45 Meter breite und 60.000 PS starke „Ane Maersk“ hat Platz für 16.600 Container und ist das erste Schiff ihrer Art, das nun mit grünem Methanol statt mit umweltschädlichem Schweröl über die Ozeane fährt.
Für Forschende wie Holger Ruland vom Max-Planck-Institut für Chemische Energiekonversion hat der Alkohol einen weiteren Pluspunkt, denn kaum ein katalytisches Verfahren ist so gut untersucht wie die Methanolsynthese. Bereits 1923 gelang es dem Chemiker Matthias Piers, den Alkohol großtechnisch aus Synthesegas (CO + H2) im Hochdruckverfahren an Zinkoxid-Chromoxid-Katalysatoren herzustellen. Noch heute gehört dies zu den „Top Five“ der katalytischen Verfahren. Bisher wurde das Synthesegas dafür durch Kohlevergasung oder aus Erdgas gewonnen. „Man kennt also die Gaszusammensetzung recht gut und weiß, wie man es aufreinigen muss. Auch an den Katalysatoren wurde inzwischen viel optimiert“, sagt Ruland, der nun Kupfer-Zink-Katalysatoren dafür einsetzt.
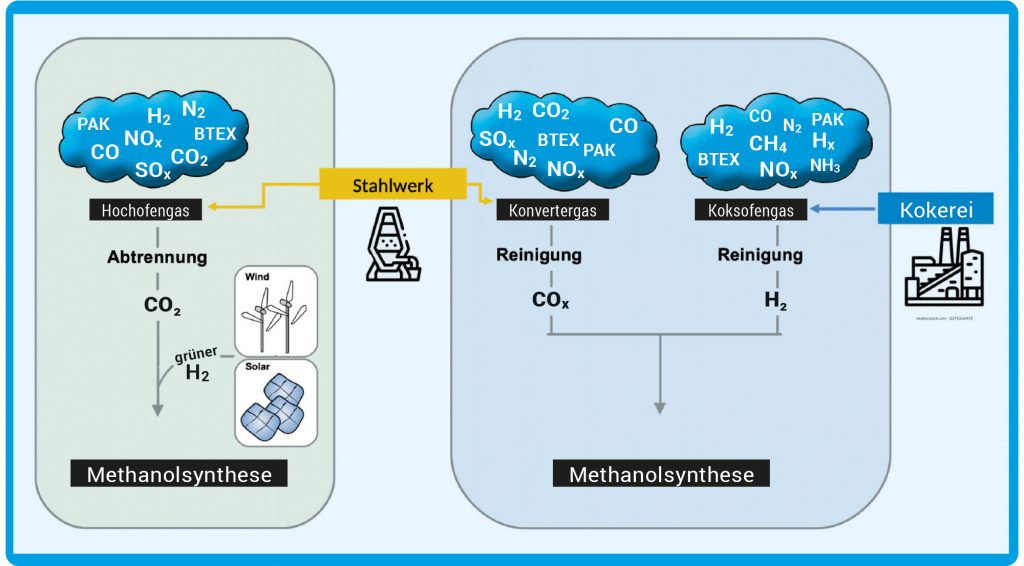
Abb. B: Möglichkeiten der Abgasverwertung. Links: Hochofengas enthält von allen Abgasen die höchste CO2-Menge. Das CO2 muss abgetrennt und danach mit H2 angereichert werden. Rechts: CO-reiches Konvertergas und H2-reiches Koksofengas werden gereinigt und gemischt. Die größte Herausforderung dabei sind Spurengase, die den Katalysator schädigen können. Die Erzeugung des H2 sollte mit erneuerbaren Energiequellen erfolgen, um eine positive Kohlenstoffbilanz zu erhalten. (BTEX: Benzol, Toluol, Ethylbenzol, Xylole. PAK: polyzyklische aromatische Kohlenwasserstoffe)
© Verändert nach Chem. Ing. Tech. 2018, 1419 ff. / https://doi.org/10.1002/cite.201800017 / CC BY-NC 4.0
Die heißen Abgase aus dem Stahlwerk in Duisburg (s. Titelbild) dürfen natürlich schon heute nicht mehr einfach in die Luft geblasen werden. Das wäre im Grunde auch Verschwendung. Durch ein verzweigtes System aus zum Teil mannshohen Rohren werden sie über das Werksgelände geleitet, zum Teil in den Prozess direkt wieder eingespeist, weil sie noch viel Kohlenstoffmonoxid und Wasserstoff enthalten. Alle anderen Gase werden herausgefiltert und zum werkseigenen Gaskraftwerk geleitet, wo sie final verbrannt werden – um Strom für das Werksgelände zu erzeugen. Für das Carbon2Chem-Pilotprojekt wird das wertvolle Gasgemisch (Hochofengas, s. Abb. B) aber direkt hinter dem Hochofen abgezwackt. Neben CO, CO2 und H2 enthält es etliche Kohlenwasserstoffe, Stickstoff und Ammoniak. Mehr als 500 Verbindungen insgesamt, viele davon nur im niedrigen ppb-Bereich und noch längst nicht alle sind analysiert. Was genau drin ist, hängt davon ab, welches Erz und welche Kohle zur Stahlherstellung verwendet wird. Damit die Methanol-Produktion später einmal in großem Maßstab und kontinuierlich laufen kann, ist es notwendig zu wissen, welche Verbindungen man unbedingt vorher herausfiltern muss, damit der Katalysator nicht streikt. Denn im Idealfall sollte seine Aktivität über mehrere Jahre nicht nachlassen. „Mehr als 100 ppb Schwefel – in welcher Form auch immer – machen Probleme, denn das Element setzt sich auf die Kupfer-Zink-Grenzflächen und vergiftet so den Katalysator“, erklärt Ruland. Die Oberfläche des Kats verliert dadurch die aktiven Zentren, an denen die Synthese stattfinden kann.
Für die Methanolsynthese können Gemische aus CO und CO2 eingesetzt werden, da beide Kohlenstoffoxide mit Wasserstoff in einer exothermen Reaktion den Alkohol bilden (Abb. C). Nach dem Prinzip von Le Chatelier lässt sich das Gleichgewicht durch Optimierung von Druck und Temperatur zugunsten des Produktes weit nach rechts verschieben. „Bei den üblichen kupferbasierten Katalysatoren geht das am besten bei 50 bis 100 bar und 240 bis 260 °C. Doch je mehr CO2 im Gasgemisch ist, desto ungünstiger ist es für das thermodynamische Gleichgewicht“, sagt Ruland (s. Erklärung in Abb. C). Man erhält also etwas weniger Methanol pro Reaktor-Durchgang, was aber durch Rückführung der Gase in den Prozess wieder ausgeglichen werden kann. Unter optimalen Bedingungen entsteht dann zu 99 Prozent reines Methanol, das zum Abschluss, je nach gewünschtem Reinheitsgrad, ein- oder zweimal destilliert wird.

Abb. C: Herstellung von Methanol aus Synthesegas Methanol wird im Wesentlichen aus CO2 gebildet, da die Hydrierung von CO2 viel schneller abläuft als von CO. Die Reaktionen (1) und (2) sind durch die Reaktion (3) gekoppelt, die ebenfalls stattfindet und katalysiert wird. Die Hinreaktionen sind in den Gleichungen 1 und 2 exotherm, in Gleichung 3 endotherm. Temperaturerniedrigung und Druckerhöhung begünstigen in den Reaktionen (1) und (2) die Methanolbildung. Da alle drei Reaktionen des Reaktionsnetzwerkes die Gleichgewichtslage beeinflussen, spielt auch die Reaktion (3) eine wichtige Rolle: Je mehr CO2 im Gas enthalten ist, desto mehr Wasser wird über die Reaktion (3) gebildet und verringert dadurch entsprechend der Gleichgewichtskonstante Keq,2 noch zusätzlich den im Gleichgewicht möglichen Methanolanteil. Ein höherer CO-Anteil im Gas hat den gegenteiligen Effekt. (pi: Partialdruck der Komponente i)
© MPG // HNBM
Für die Stahlherstellung wird Eisenerz, ein Gemenge von Eisenoxiden (Magnetit und Hämatit) und -carbonat (Siderit), zunächst zu einem Sinterkuchen „verbacken“ und dann in grobe Stücke zerbrochen. Zeitgleich wird in der Kokerei Kohle in Koks, also fast Hochofengas reinen Kohlenstoff, umgewandelt. Dabei entsteht das Koksofengas, was zusammen mit dem Konvertergas für die Methanolsynthese verwendet werden kann (s. Abb. B). Koks dient später im Hochofen zusammen mit Kohlenstoffmonoxid als Reduktionsmittel für die Eisenoxide. Im Rahmen der grünen Transformation sollen dieser Prozess, der extrem viel CO2 erzeugt, sowie die Energieversorgung der Stahlwerke baldmöglichst durch Direktreduktion mittels grünem Wasserstoff ersetzt werden. Auch wenn die Stahlherstellung irgendwann beinahe „grün“ sein wird, macht es trotzdem Sinn, Carbon2Chem hier zu erproben und anzuwenden. Denn es gibt es noch einen zweiten Prozess beim „Stahlkochen“: Wenn das Roheisen mit Stahlschrott verschmolzen wird – in der sogenannten Konverter-Route – wird ebenfalls CO2 freigesetzt, wenn auch weit weniger. Und dieser Anteil wird sich nicht vermeiden lassen.
Aus Synthesegas lassen sich nicht nur Methanol herstellen, sondern auch höhere Alkohole und beispielsweise auch Methan – mit Hilfe von Nickelkatalysatoren. Das ist quasi „nachhaltiges“ Erdgas. Klar kann man das zur Energiegewinnung einfach „verheizen“, was nicht sonderlich klimafreundlich wäre. Methan ist jedoch, ebenso wie Wasserstoff, auch ein möglicher Zwischenspeicher für erneuerbare Energien. Über die Fischer-Tropsch-Synthese sind zudem langkettige Kohlenwasserstoffe zugänglich: Alkane und Alkene, die für die Kunststoffindustrie interessant sind. Und Oxomethylenether, eine Art Dieselderivat, das aber rußfrei verbrennt.
Das Hochofengas enthält neben CO2 auch etwa 50 Prozent Stickstoff. Auch der lässt sich nutzen und mit Wasserstoff im Haber-Bosch-Verfahren zu Ammoniak umsetzen, einem weiteren begehrten Grundstoff (s. Techmax 10). „Das passt zwar auf den ersten Blick nicht zum Carbon2Chem-Gedanken. Aber Ammoniak wird mit Kohlenstoffdioxid weiter zu Harnstoff umgesetzt, und so erzielt man dann auch einen CO2-Minderungseffekt“, erklärt Holger Ruland. 80 Prozent der weltweiten Ammoniakproduktion werden in Salpetersäure umgewandelt. „Ohne die daraus erzeugten Düngemittel hätte sich die Weltbevölkerung nicht so rasant entwickeln können, weil nicht ausreichend Nahrungsmittel zur Verfügung gestanden hätten“, sagt Holger Ruland.
Wenn der Hochofen durch Direktreduktion ersetzt wird, ändert sich natürlich die Gasverfügbarkeit am Stahlwerk. „Wir müssen deshalb für die Übergangsperioden gut planen, um dann noch wirtschaftlich Methanol am Standort erzeugen zu können.“ Ob es rentabel ist, wird letztlich auch davon abhängen, wieviel überschüssiger Strom aus Solar- und Windkraftanlagen, der nicht gespeichert werden kann, pro Jahr zur Verfügung stehen wird. „Ein industrieller Prozess läuft üblicherweise 8.000 Stunden pro Jahr kontinuierlich. Das wird in einem erneuerbaren System so sicher nicht möglich sein. Sind es aber nur 1.000 Stunden, wäre das unwirtschaftlich.“ Teilweise ließe sich das über Zwischenspeicher abpuffern. Sprich: Indem man den Überschussstrom schon mal nutzt, um grünen Wasserstoff auf Vorrat zu produzieren. Denn Strom, der aus Kohle oder Erdgas kommt, für die Methanolsynthese zu verwenden, wäre nicht nachhaltig und der Kohlenstoffkreislauf wäre nicht geschlossen.
Die Pilotanlage in Duisburg erzeugt pro Tag bereits 50 Liter Methanol. Demnächst soll ein Scale-up in eine größere Anlage erfolgen, die schon im Tonnen-Maßstab arbeiten wird. Und wenn alles gut läuft, könnte das Verfahren vielleicht schon in fünf Jahren industriell eingesetzt werden. Damit ließe sich, wie Holger Ruland meint, der Methanol-Markt „regelrecht fluten“. Vorausgesetzt natürlich, der Preis für das Produkt stimmt! Und der hängt unter anderem davon ab, wie teuer der grüne Wasserstoff für die Herstellung des Methanols ist und wie hoch die CO2-Abgabe sein wird, die nicht nachhaltige Produkte verteuert. Ein ebenso komplexes wie hochpolitisches Thema.
Dass es für Umweltprobleme gute Lösungen gibt, zeigt ein Blick in die jüngere Vergangenheit. Gesundheitsschädliche Schwefelgase, die bei der Verbrennung von Kohle und Müll entstehen, werden seit 1983 durch Rauchgas-Entschwefelungsanlagen (REA) aus den Abgasen von Kraftwerken und Müllverbrennungsanlagen herausgewaschen und in Calciumsulfat umgewandelt. Dieser REA-Gips deckt den Gipsbedarf der Baubranche derzeit zu 40 Prozent. „Sulfur Capture and Use“ sozusagen, lange bevor es den Begriff gab. Zweites Beispiel: Das Ozonloch. 1985 wurde es erstmals über dem Südpol entdeckt und bereits zwei Jahre später die Ursache dafür erkannt. Bereits 1987 unterzeichneten 197 Staaten das Montreal-Protokoll und verpflichteten sich, Produktion und Verbrauch der acht wichtigsten Fluor-Chlor-Kohlenwasserstoffe (FCKW) drastisch zu reduzieren. Inzwischen verkleinert sich das Ozonloch über der Antarktis merklich und Forschende gehen davon aus, dass es in 50 bis 100 Jahren wieder ganz geschlossen sein wird.
„In beiden Fällen waren die Verursacher punktuell und deshalb auch gut abzustellen. Das Zuviel an Kohlenstoffdioxid entsteht jedoch überall“, betont Holger Ruland. „Deshalb wird ein vielfältiger Mix von Technologien nötig sein, um CO2 sowohl zu vermeiden, als auch zu verwerten und zu lagern.“ Auch Carbon Capture and Storage (CCS) wird aus seiner Sicht Teil der Lösung sein. „Vor allem an Standorten, an denen es keine Industrieansiedlungen gibt, die das Gas nutzen könnten, macht es Sinn, es zu verflüssigen und in unterirdische Kavernen zu pumpen. Am besten dort, wo man früher Erdgas herausgeholt hat.“
CCU-Technologien voranzutreiben, meint Ruland, werde gerade in der Übergangszeit wichtig sein, bis es tatsächlich gelingt, einen geschlossenen Kreislauf herzustellen. In dieser Phase gilt es, alle anderen chemischen Verfahren, die jetzt noch auf fossilen Rohstoffen basieren, zu prüfen und umzustellen, um die Kohlenstoffverwertungskette wirklich nachhaltig zu machen. Auf lange Sicht wird man auch um Direct Air Capture (DAC) nicht herum kommen. Auch wenn es aktuell noch nicht wirklich rentabel ist. Ein kniffliges Problem: Zwar führen 417 ppm schon jetzt zu dramatischen Klimaveränderungen auf der Erde. Neben 78,08 Prozent Stickstoff, 20,95 Prozent Sauerstoff und rund einem Prozent an Edelgasen und anderen, wirken die 0,04 Prozent Kohlenstoffdioxid jedoch wie ein „Spurenelement“. Und dies über Absorber aus dem Gasgemisch gezielt herauszufischen, ist eine technische Herausforderung. Aber keine unlösbare! In Island wurde im Mai 2024 „Mammoth“, die weltweit größte Anlage für Direct Air Capture and Storage (DAC+S) in Betrieb genommen. Der „CO2-Sauger“ des Schweizer Unternehmens Climeworks, das aus einem Spin-off der Eidgenössischen Hochschule Zürich entstanden ist, soll pro Jahr 36.000 Tonnen Kohlenstoffdioxid aus der Luft filtern und unterirdisch speichern. Der Strom für die sehr energieintensive Anlage wird übrigens zu 100 Prozent „grün“ erzeugt – durch Geothermie.
Das Carbon2Chem-Verfahren soll natürlich auch in anderen CO2-intensiven Industriezweigen angewendet werden – zum Beispiel bei der Zementherstellung oder der Müllverbrennung. Letztere wird nie aufhören, auch wenn die Menge der Abfälle, in Deutschland 2023 erstmals knapp unter die 400-Millionen-Tonnen-Marke fiel. 82 Prozent davon werden übrigens bereits jetzt „stofflich oder energetisch verwertet“. Sprich: recycelt oder verbrannt und die Abwärme für Fernwärme oder zur Stromerzeugung genutzt. Da Plastikmüll zum größten Teil aus Kohlenstoff besteht und deshalb ein wertvoller Rohstoff ist, wird auch an Verfahren für das chemische Recycling geforscht, um nicht-sortenreine Kunststoffabfälle wiederzuverwerten. Bis diese Verfahren im großen Maßstab angewendet werden können, wäre es aber auch schon ein nachhaltigerer Weg, „Plastikmüll zur Energieerzeugung zu verbrennen und das entstehende CO2 einzufangen und mit Hilfe von Carbon2Chem umzuwandeln“, sagt Holger Ruland.
Abbildungshinweise:
Titelbild © thyssenkrupp Steel Europe AG
Abb. A: © Quelle: DECHEMA & FutureCamp: ROADMAP CHEMIE 2050. 2019, S. 76. ISBN: 978-3-89746-223-6
Abb. B: © Verändert nach Chem. Ing. Tech. 2018, 1419 ff. / https://doi.org/10.1002/cite.201800017 / CC BY-NC 4.0
Abb. C: © MPG //HNBM
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
TECHMAX Ausgabe 35, Juli 2024; Text: Dr. Catarina Pietschmann; Redaktion: Dr. Tanja Fendt
Zwei Erklärvideos des MPI für Polymerforschung zu den Themen Polymere, Nanokapseln, künstliche Zellen
Herstellung von Nanokapseln (8 min)
Das Video erklärt die einzelnen Syntheseschritte im Labor und welche Qualitätskontrollen durchlaufen werden müssen, um die „perfekte“ Nanokapsel herstellen zu können.
Themen im Film: Synthese von Nanokapseln (ab min 1:05) // Charakterisierung der Nanokapseln (ab min 2:23) // Zellexperimente (ab min 5:03) // Gewebetests ( ab min 6:10) // Anwendung am Menschen (ab min 6:45)
> Zum Film auf der Website des MPI
Nanokapseln als künstliche Zellkompartimente (7 min)
Wie werden künstliche Zellen synthetisiert? Zuerst müssen dafür aktive Nanokapseln mit einer polymeren Zellmembran aufgebaut werden. Die Nanokapseln bilden einzelne Kompartimente, die Funktionen einer biologischen Zelle nachahmen. Forschungs-Teams ist es gelungen, Reaktionen in einer künstlichen Zelle zu rekonstruieren und gezielt zu steuern. Dadurch ist es möglich, die Natur besser zu verstehen und die Erkenntnisse z.B. für die Medizin zukünftig nutzbar zu machen.
Themen im Film: Nanokapseln als Zellkompartiment (ab min 1:28) // Herstellung der Zellmembran (ab min 2:30) // Untersuchung der künstlichen Minikraftwerke und deren Reaktionen (ab min 5:20)
Zum Film auf der Website des MPI
Abbildung: © MPI für Polymerforschung
Luftschadstoffe wie Stickstoffoxide und Ozon beeinflussen die Pheromone von Insekten. Die C-C-Doppelbindungen in den Molekülen werden durch Ozon und Stickstoffoxide angegriffen. Der Kurzfilm (2 min) erklärt die Erkenntnisse aus der Forschung.
Markus Knaden und Bill Hansson vom MPI für chemische Ökologie sprechen im Interview über die Folgen für die Insektenwelt.
Weitere Infos im Newsroom auf mpg.de
Das passende TECHMAX-Heft erklärt, wie Stickstoffoxide die Bildung von Ozon befördern und Forschende die Emissionsquellen sichtbar machen.
Datenschutzhinweis: Mit dem Klick auf den Play-Button starten Sie ein YouTube-Video. Vorher werden keine Daten an YouTube übertragen.
YouTube-Link: https://youtu.be/u8ApNHqamMg
[Dauer des Videos: 2 min]
Recherche-Aufgabe zum Contergan-Skandal.
Unterrichtsmaterial zum Techmax 30.
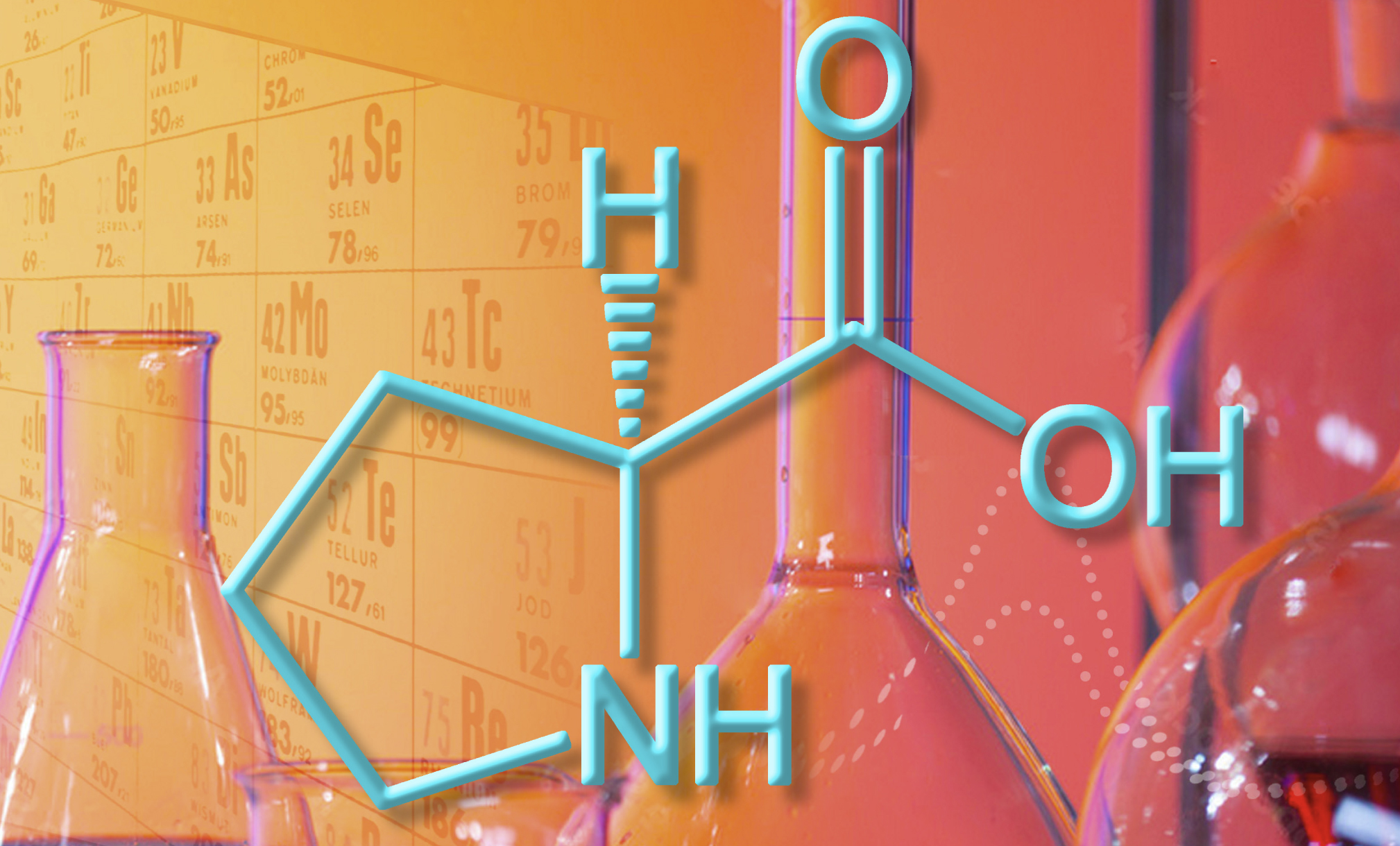
Über sein Stickstoff-Atom bindet Prolin zunächst an den Kohlenstoff der Carbonyl-Gruppe (1) eines Ketons (a). Nach Wasserabspaltung (2) und Umlagerung (3) entsteht ein Enamin. Dieses greift nukleophil am Kohlenstoff-Atom der Carbonyl-Gruppe eines Aldehyds an (4). Das kann theoretisch von zwei Seiten erfolgen, doch einer der beiden Übergangszustände ist deutlich begünstigt. Der Wasserstoff der Säuregruppe im Prolin stabilisiert den Übergangszustand zunächst und bindet dann an das O-Atom aus dem Aldehyd (5). Nach anschließender Hydrolyse (6) entsteht das Produkt (7) und das wieder frei gewordene Prolin-Molekül kann den nächsten Zyklus starten. Die Enantioselektivität besteht in einer klar bevorzugten Lage der OH-Gruppe am Stereozentrum des Produkts – und resultiert aus dem begünstigten Übergangszustand.
© S. Brunen, MPI für Kohlenforschung / CC BY-NC-SA 4.0
© HNBM
Ohne Katalysatoren sähe unsere Welt anders aus. So wäre etwa die Luftqualität schlechter, weil Autos mehr Schadstoffe ausstoßen würden. Etliche Dinge um uns herum, vielleicht sogar die meisten, würde es gar nicht geben. Keine Kunststoffe, weniger Medikamente, und mangels Kunstdünger würden noch viel mehr Menschen hungern. Auch bei der Reduktion klimaschädlicher Emissionen helfen Katalysatoren. Sie entfernen beispielsweise das Treibhausgas Distickstoffoxid aus Abgasen, die unter anderem bei den Synthesen von Salpetersäure und Nylon-Rohstoffen entweichen.
Wir verdanken den Reaktionsbeschleunigern also eine ganze Menge. Schätzungen zufolge sollen Katalysatoren bei 80 bis 90 Prozent aller chemischen Prozesse im Einsatz sein. „Es wurde kalkuliert, dass die damit geschaffenen Produkte bis zu einem Drittel des weltweiten Bruttoinlandsprodukts beitragen“, sagt Benjamin List über sein Arbeitsgebiet, die Katalysatorforschung. Der Chemiker ist Direktor am Max-Planck-Institut für Kohlenforschung und hält die Katalyse für „eine der wichtigsten Technologien der Menschheit“.
Die Geschichte der Katalyse ist praktisch so alt wie die der Chemieindustrie. Auch ohne theoretischen Hintergrund und ohne die Mechanismen zu kennen, lernten die Praktiker früh, dass viele wichtige Reaktionen unter bestimmten Bedingungen schneller ablaufen. Als eines der ersten Beispiele der industriellen Katalyse gilt das 1746 entwickelte Bleikammerverfahren für die Schwefelsäuregewinnung. Dabei katalysiert Stickstoffdioxid die Oxidation von Schwefeldioxid zu Schwefeltrioxid. Beim im 19. Jahrhundert entwickelten Kontaktverfahren wirkte erst Platin und später Vanadiumpentoxid als Katalysator. Egal ob Chlor, Salpetersäure, Kunststoffe, Methanol, der blaue Farbstoff Indigo oder das für die Düngemittelherstellung wichtige Ammoniak – bei den Synthesen unzähliger wichtiger Chemikalien sorgen erst Katalysatoren für nennenswerte Umsetzungsgeschwindigkeiten.
Eine der frühesten Definitionen der Katalyse stammt von Wilhelm Ostwald, der sich Ende des 19. Jahrhunderts intensiv mit dem Einfluss von Katalysatoren auf chemische Reaktionen beschäftigt hatte. Darin trug er dem Effekt auf die Reaktionsgeschwindigkeit bereits Rechnung. Später leitete man daraus die bis heute gültige Beschreibung ab, nach der ein Katalysator ein Stoff ist, der die Geschwindigkeit einer chemischen Reaktion erhöht oder den Ablauf einer Reaktion erst ermöglicht, ohne dabei selbst verbraucht zu werden. Ostwald verglich diesen Effekt mit der Wirkung von Schmieröl auf die Räder eines Uhrwerks. In beiden Fällen würden vorhandene Widerstände herabgesetzt: im Uhrwerk der durch die mechanische Reibung, im Chemiereaktor der durch die Energiebarriere. Für seine grundlegenden Arbeiten erhielt Ostwald 1909 den Nobelpreis für Chemie.
Wichtig in diesem Zusammenhang: Ein Katalysator kann nur solche Reaktionen beschleunigen oder ermöglichen, die auch thermodynamisch begünstigt sind, bei denen also das Energieniveau der Produkte niedriger liegt als das der Edukte. Genauso wichtig: Das thermodynamische Gleichgewicht einer Reaktion wird von Katalysatoren nicht beeinflusst. Kennzeichnend für einen Katalysator ist, dass er die Aktivierungsenergie herabsetzt, die aufgewendet werden muss, um bestehende Bindungen zu lösen, damit ein neuer Zustand mit neuen Bindungen entstehen kann. Üblicherweise senken Katalysatoren diesen Energieaufwand, indem sie besondere Übergangszustände ermöglichen, die mit weniger Energieeinsatz zu erreichen sind. Sie tun dies, indem sie beispielsweise vorübergehend kovalente oder Wasserstoffbrücken-Bindungen mit einem der Reaktionspartner eingehen – und so dessen Reaktivität beeinflussen.
Übrigens stimmt das mit dem „Nicht-verbraucht-Werden“ in der Praxis nicht immer. Gerade in der heterogenen Katalyse, bei der die Katalysatoren meistens auf einer festen Phase aufgebracht sind, kommt es im Laufe des Prozesses durchaus zu Veränderungen, etwa zu Verkokungen oder Sintervorgängen. Die Betreiber solcher Prozesse müssen ihr Katalysatormaterial daher von Zeit zu Zeit erneuern.

Wie bedeutsam die Katalyse für die Chemie ist, beweist auch ein Blick nach Stockholm. Nach Wilhelm Ostwald wurden dort viele weitere Wissenschaftler namentlich für Fortschritte in der Katalyseforschung mit dem Chemie-Nobelpreis ausgezeichnet (Abb. A). Im Jahr 2021 ehrte man Benjamin List und David MacMillan mit dem renommierten Preis – und zwar „für die Entwicklung asymmetrischer Organokatalysatoren“. Um die Jahrtausendwende herum hatten beide Forscher, unabhängig voneinander, die Tür zu diesem neuen Spezialgebiet der Katalyse aufgestoßen.
Von Organokatalyse sprechen Chemiker, wenn es sich bei den Katalysatoren um organische Moleküle handelt. Dass diese chemische Reaktionen beschleunigen können, ist lange bekannt. Schon Justus von Liebig machte vor bald 200 Jahren davon Gebrauch, als er unter anderem für die Bildung aromatischer α-Hydroxyketone Cyanid als Katalysator einsetzte oder später den katalytischen Effekt von Acetaldehyd auf eine andere Synthese entdeckte. Neu an den Arbeiten von List und MacMillan war aber die asymmetrische Synthese mit organischen Katalysatoren. Mit „asymmetrisch“ sind Reaktionen gemeint, die selektiv nur zu einem von zwei möglichen Enantiomeren führen. Diese Spiegelbildisomer-Paare gibt es zum Beispiel dann, wenn ein Molekül ein Stereozentrum enthält.
Synthesen, die selektiv vor allem zu einem Enantiomer führen, sind häufig bei Substanzen gefragt, die in biologischen Systemen eingesetzt werden sollen, also zum Beispiel bei Medikamenten, Mitteln für die Schädlingsbekämpfung oder auch bei Duft- und Aromastoffen. Das liegt daran, dass oft nur eines der beiden Enantiomere den gewünschten Effekt hat, also etwa eine pharmazeutische Wirkung oder einen bestimmten Geruch und Geschmack. Einer Abschätzung aus dem Jahr 2017 zufolge besitzt etwa jede zweite in der Medizin eingesetzte Substanz ein Stereozentrum. Doch längst nicht in allen Fällen gelingt den Herstellern eine enantioselektive Synthese.
Die Anforderungen an einen asymmetrischen Katalysator sind hoch. Es reicht nicht, wenn er lediglich die Aktivierungsenergie senkt. Um dabei auch noch enantioselektiv auf den Reaktionsverlauf zu wirken, muss er eine ganz bestimmte räumliche Umgebung für die an der Reaktion beteiligten Moleküle schaffen. Erst sie führt dazu, dass zum Beispiel die Anlagerung eines Reaktionspartners an den anderen nur von einer Seite aus erfolgen kann, weil die andere abgeschirmt wird. Bei Enzymen sorgt die komplexe Struktur des Eiweißmoleküls für diese „sterische Kontrolle“. Bei Katalysatoren auf Basis von Übergangsmetallen erreicht man den Effekt dadurch, dass man die Metallatome zuvor mit geeigneten Molekülgerüsten, auch Liganden genannt, umgibt. In beiden Fällen führt die entscheidende Reaktion aus räumlichen (sterischen) Gründen bevorzugt nur zu einem Enantiomer, während die Bildung des Spiegelbild-Moleküls deutlich erschwert ist.
Es ist noch gar nicht lange her, da ist man davon ausgegangen, dass ausschließlich die genannten Übergangsmetall-Komplexe und Enzyme für asymmetrische Katalysen in Frage kommen. Erst die Nobelpreisträger von 2021 haben das Konzept etabliert, dass sich auch kleine organische Moleküle wie etwa Prolin dafür eignen (Abb. B).
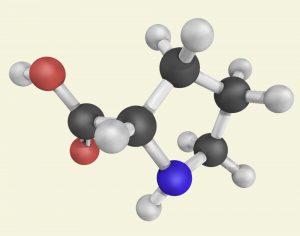
Abb. B: L-Prolin wird im menschlichen Körper zum Beispiel für die Bildung von Kollagen benötigt. Die Entdeckung seiner katalytischen Wirkung eröffnete das Feld der asymmetrischen Organokatalyse. Das Molekül ist klein, kostengünstig, ungiftig und steuert äußerst selektiv chemische Reaktionen.
© ibreakstock / Adobe Stock
Benjamin List forschte zunächst an Proteinkatalysatoren auf Antikörperbasis. Durch Kristallstrukturanalysen stellte sich heraus, dass an der Katalyse sowohl eine Amino- als auch eine Säuregruppe des Antikörpers beteiligt waren. List fragte sich: „Hat ein einfaches organisches Molekül vielleicht dieselbe Wirkung, wenn es eine Amino- und eine Säuregruppe besitzt?“ Also zum Beispiel eine Aminosäure? In seinem ersten Versuch testete er, ob die natürliche Aminosäure L-Prolin die Aldolreaktion von Aceton mit Aldehyden enantioselektiv katalysieren könnte. Es gelang: Der dabei von Keton und Prolin gebildete Enamin-Zustand ging tatsächlich räumlich kontrollierte Reaktionen mit Aldehyden ein (Abb. C).
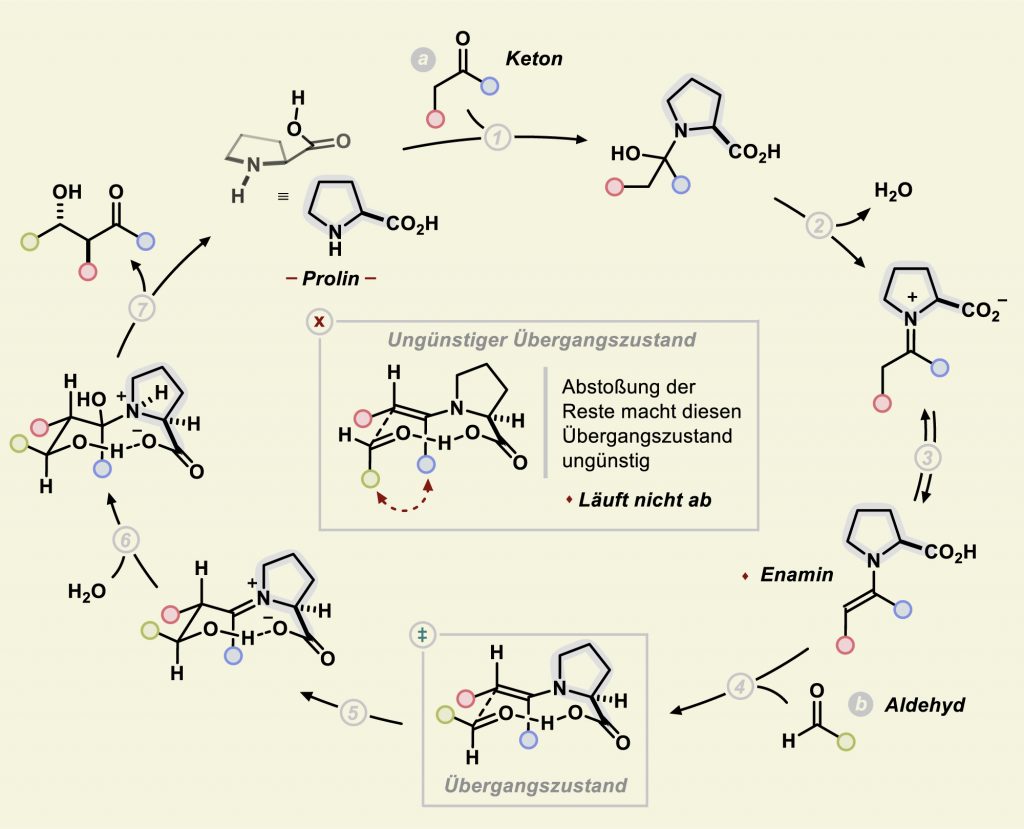
Abb. C: Enamin-Katalyse mit Prolin: Über sein Stickstoff-Atom bindet Prolin zunächst an den Kohlenstoff der Carbonyl-Gruppe (1) eines Ketons (a). Nach Wasserabspaltung (2) und Umlagerung (3) entsteht ein Enamin. Dieses greift nukleophil am Kohlenstoff-Atom der Carbonyl-Gruppe eines Aldehyds an (4). Das kann theoretisch von zwei Seiten erfolgen, doch einer der beiden Übergangszustände ist deutlich begünstigt. Der Wasserstoff der Säuregruppe im Prolin stabilisiert den Übergangszustand zunächst und bindet dann an das O-Atom aus dem Aldehyd (5). Nach anschließender Hydrolyse (6) entsteht das Produkt (7) und das wieder frei gewordene Prolin-Molekül kann den nächsten Zyklus starten. Die Enantioselektivität besteht in einer klar bevorzugten Lage der OH-Gruppe am Stereozentrum des Produkts – und resultiert aus dem begünstigten Übergangszustand.
© S. Brunen, MPI für Kohlenforschung / CC BY-NC-SA 4.0
Seit dieser Arbeit sind erst etwas mehr als 20 Jahre vergangen. In dieser Zeit hat sich das Feld der Organokatalyse rasant entwickelt. Viele Forschungsgruppen in aller Welt beschäftigen sich damit. Das ist kein Wunder: Anders als die meisten Metallverbindungen sind Organokatalysatoren in der Regel einfacher (und prinzipiell aus nachhaltigen Rohstoffen) herzustellen, meistens günstiger im Preis und ungiftig. Übergangsmetalle müssen dagegen häufig unter ökologisch schwierigen Bedingungen aus ohnehin begrenzten und zum Teil schwer zugänglichen Erzvorkommen gewonnen werden. Und im besten Fall sind auch die Reaktionsbedingungen moderat. Die Aldolreaktion mit Prolin etwa verläuft in wenigen Stunden bei Raumtemperatur. Gründe genug also, möglichst viele chemische Reaktionen mithilfe organischer Katalysatoren zu beschleunigen.
Dass sich diese prinzipiell auch für asymmetrische Katalysen eignen, hat die Forschung besonders beflügelt. Denn diese Reaktionen bereiten der Industrie häufig Kopfzerbrechen. Gelingt eine enantioselektive Kontrolle der Reaktion nicht, hat dies gleich zwei Nachteile. Zum einen reduziert es die Ausbeute des gewünschten Enantiomers, wenn ein Teil der Ausgangsstoffe zum unerwünschten Isomer reagiert. Zum anderen verursacht es Aufwand, Energie und Kosten, das gewünschte Enantiomer von seinem Spiegelbild abzutrennen. Hersteller sind also bestrebt, die Synthese möglichst selektiv zu gestalten. Es gibt aber immer noch Fälle, in denen eine enantioselektive Synthese bisher gar nicht gelang und Hersteller geringere Ausbeuten und eine Enantiomeren-Trennung in Kauf nehmen müssen. Etliche Medikamente enthalten der Einfachheit halber das Racemat, also die Mischung beider Enantiomere. Das geht natürlich nur, wenn die unerwünschte Variante des Moleküls unschädlich ist.
Vor diesem Hintergrund können organische Katalysatoren durchaus neue Akzente setzen. So etwa bei der Synthese von Sitagliptin, einem Wirkstoff in Medikamenten zur Behandlung von Typ-2-Diabetes. Für den letzten Syntheseschritt, eine enantioselektive Hydrierung, gibt es seit einigen Jahren auch eine Lösung mit einem organischen Katalysator, einem sogenannten Dithiomalonat, der technische Herausforderungen beim Einsatz der früher üblichen Metallkatalysatoren vermeidet. Ein weiteres Beispiel ist die Reaktion von Blausäure mit 2-Butanon, die zu einer wichtigen Vorstufe einiger Arzneimittelwirkstoffe führt. Lange Zeit gab es keine nennenswert enantioselektive Route. Im Jahr 2022 publizierte Benjamin List mit seinem Team erstmals eine organische Katalyse mit hoher Enantioselektivität. Das Katalysatormolekül ist deutlich größer und komplexer als Prolin. „Das ist inzwischen üblich“, erklärt List, „und liegt unter anderem daran, dass wir damit eine stärkere räumliche Kontrolle auf Reaktionen gewinnen.“ Außerdem würden heutige Katalysatormoleküle gezielt so designt, dass sie deutlich effektiver wirken, man also weniger von ihnen benötigt. Musste man Prolin für die Aldolreaktion noch in Konzentrationen von mehr als 20 Prozent den Reaktionspartnern beimischen, genügen bei vielen modernen Organokatalysatoren weniger als ein Prozent, zum Teil sogar deutlich weniger.
Dass im Extremfall ein einziges Katalysator-Molekül ausreicht, um damit Produkte im Tonnenmaßstab herzustellen, ist für Benjamin List gerade das Faszinierende an seinem Arbeitsgebiet. Er spricht auch gerne von „magischen Molekülen“, weil man sie durchaus mit „dem Zauberstab“ eines Magiers vergleichen könne. „Der Zauberer verwandelt Gegenstände damit, wir Chemiker wandeln Moleküle um“, so List.
Mit seinem Team arbeitet der Nobelpreisträger unermüdlich an weiteren Katalyse-Innovationen (Abb. D) – durchaus auch mit dem Ziel, die Chemie tiefgreifend zu verändern. Unter anderem hofft List, dass sich viele wichtige Chemikalien in Zukunft einfacher und in weniger Reaktionsschritten synthetisieren lassen, vielleicht sogar direkt aus den Bestandteilen des Erdöls, das vorerst für viele chemische Produkte ein unersetzlicher Rohstoff bleibe.

Abb. D: Benjamin List und seine Mitarbeitenden entwickeln gemeinsam Ideen für neue Reaktionen. Als Tafel dient ihnen dabei die Frontscheibe eines Abzugs.
© David Ausserhofer/MPG
Für wie wichtig Benjamin List Katalysatoren bei der Bewältigung der Zukunftsaufgaben hält, hat er in seinem Vortrag anlässlich der Nobelpreisverleihung unterstrichen, als er sagte: „Die aktuellen Herausforderungen für die Menschheit, wie Klimawandel oder Energiekonversion, werden nur mit Hilfe der Katalyse gelingen.“ In Bezug auf das wichtigste Treibhausgas, das Kohlenstoffdioxid, hat er persönlich eine ganz besondere Vision. In kühnen Momenten träumt er davon, dieses Gas einfach aus der Atmosphäre herauszuholen und mittels UV-Licht direkt in Kohlenstoff und Sauerstoff zu zerlegen. „Den Kohlenstoff könnte man verbuddeln“, sinniert List. Voraussetzung für das ganze Szenario wäre aber zunächst ein geeigneter Katalysator, der die starken Doppelbindungen zwischen Kohlenstoff und den beiden Sauerstoffatomen knackt, ohne dass sich direkt neue Bindungen bilden.
Dennoch wird es nicht für jede Reaktion einen organischen Katalysator geben können. Und dort, wo es ihn gibt, muss das nicht automatisch die bessere Lösung sein. Auch Benjamin List räumt ein, dass es Fälle gebe, wo „Metall-Katalysatoren kaum zu ersetzen sind“. Der Max-Planck-Forscher hält die Organokatalyse aber für ein „wichtiges weiteres Werkzeug“ im Repertoire. Metalle und Enzyme behielten gleichwohl ihre Daseinsberechtigung in der Katalyse. Allerdings gelte in der Regel: Bringen organische Moleküle auch nur annähernd dieselbe Effizienz, dann haben sie oft klare Vorteile, wie zum Beispiel die größere Nachhaltigkeit. Letztlich geht es schließlich für die gesamte Chemiebranche auch darum, „grüner“ zu werden. Das heißt, mit Prozessen zu arbeiten, die weniger Energie benötigen, auf möglichst nachhaltigen Rohstoffen basieren und kaum Abfall verursachen.
Abbildungshinweise:
Titelbild: © HNBM
Abb. B: © ibreakstock / Adobe Stock
Abb. C: © S. Brunen, MPI für Kohlenforschung / CC-BY-NC-SA 4.0
Abb. D: © David Ausserhofer / MPG
Der Text wird unter CC BY-NC-SA 4.0 veröffentlicht.
TECHMAX 30, Sommer 2022; Text: Dr. Karl Hübner; Redaktion: Dr. Tanja Fendt
Die Aufgabensammlung behandelt folgende Themen:
Polyaddition, Polyurethan, Nylon, Polyethylenglykol, radikalische Polymerisation
Fragen zum Film „Vom Monomer zum Nanopartikel“
Proteinmoleküle, die durch die Reaktion einer Azid-Gruppe mit einem Dialkin miteinander vernetzt wurden. Das Fenster zeigt, wie die Reaktion an der Kapselwand abläuft (rote Pfeile).
R1: Proteinmolekül, R2: Dialkin, blau: wässriger Nanotropfen, gelb: umgebende ölige Phase, grün: Proteinmoleküle.
© R. Wengenmayr verändert nach MPI für Polymerforschung / CC BY-NC-SA 4.0
Herstellung einer Nanokapsel aus Polyurethan durch eine Polyadditionsreaktion. Links unten ist das Diisocyanat, darüber das Diol, rechts vom Reaktionspfeil das fertige Polymer.
© R. Wengenmayr verändert nach MPI für Polymerforschung / CC BY-NC-SA 4.0
Der Ablauf zeigt zunächst die Herstellung einer Emulsion aus einer öligen Phase (bräunlich), die einen Emulgator enthält, und einer wässrigen Phase (blau) mit dem Wirkstoff und der Hydroxyethylstärke für die zukünftige Kapselwand. Mixen erzeugt selbstorganisierte Tröpfchen in der öligen Phase, die den Wirkstoff und die wässrige Phase umschließen. Der dritte Schritt ist ihre Zerkleinerung in eine Miniemulsion, entweder durch Ultraschall oder mit dem Homogenisator. Anschließend wird ein Vernetzer zugegeben. Dieser startet die Polymersation, hier die Vernetzung der Stärkemoleküle zur Kapsel. Am Schluss kommen die Nanokapseln in eine „umgedrehte“, also wieder wässrige Lösung (blau), die für den menschlichen Körper gut verträglich ist.
© R. Wengenmayr verändert nach MPI für Polymerforschung / CC BY-NC-SA 4.0